Супрессивная терапия это что такое
Роль супрессивной терапии при часто рецидивирующем герпесе
В статье представлены современные подходы к назначению терапии при острых проявлениях герпесвирусной инфекции, а также к выбору препаратов в целях профилактики ее обострений.
В статье представлены современные подходы к назначению терапии при острых проявлениях герпесвирусной инфекции, а также к выбору препаратов в целях профилактики ее обострений.
Герпесвирусные инфекции (ГВИ) широко распространены в мире. В частности, в Европе частота встречаемости достигает 50–80%, в странах Азии – до 90–100% [1]. Свыше 90% населения планеты инфицированы вирусом простого герпеса (ВПГ). До так называемой сексуальной революции прослеживалась четкая зависимость между типом ВПГ и локализацией высыпаний: ВПГ 1-го типа чаще связывали с локализацией в области лица, ВПГ 2-го типа – с генитальной локализацией. В последние годы подобная зависимость утратила актуальность из-за возросшей популярности орогенитальных контактов.
Входными воротами для инфекции служат поврежденные слизистые оболочки и кожа. После инфицирования ВПГ восходит по периферическим нервам до ганглиев, где сохраняется на протяжении жизни. Обратите внимание: в большинстве случаев инфицирование начинается в детском возрасте. При латентной форме ВПГ 1-го типа персистирует в ганглиях тройничного нерва, ВПГ 2-го типа – в ганглиях крестцового сплетения. При активации вирус распространяется по нерву к первоначальному очагу поражения.
Среди врачей разных специальностей бытует мнение, что только тяжелые формы рецидивирующих ГВИ кожи или слизистых оболочек, инфекционный мононуклеоз, ветряная оспа и опоясывающий герпес требуют применения специфических этиотропных препаратов. Кроме того, часто необоснованно назначают различные иммуномодулирующие препараты в виде монотерапии. Отсутствие этиотропного лечения и наличие сопутствующих заболеваний и состояний, которые расцениваются как провоцирующие факторы, угнетающие иммунный ответ (аутоиммунные заболевания, заболевания желудочно-кишечного тракта и эндокринной системы, острые и хронические воспалительные заболевания органов малого таза, психотравма и хронический стресс, воздействие ультрафиолетового излучения, употребление алкоголя, гормональные циклы, медицинские инвазивные вмешательства, злокачественные новообразования и иммуносупрессивная терапия при их лечении), снижают эффективность терапии, приводят к частым рецидивам заболевания и распространению ГВИ в популяции.
Клинические формы проявления ГВИ крайне разнообразны. Только при поражении кожи и слизистых оболочек выделяют [2]:
Герпесвирусные инфекции классифицируют по степени тяжести [3]:
Диагностика ВПГ представляет большую медико-социальную проблему, поскольку клинические проявления разнообразны и зависят от множества причин: типа вируса, генетической устойчивости человека к ВПГ, тяжести и длительности заболевания, состояния иммунного статуса, механизма инфицирования, вирусной нагрузки, возраста пациента, давности заболевания, наличия сопутствующей патологии.
Алгоритм диагностики ГВИ включает:
В клинической практике для постановки диагноза ВПГ обычно ограничиваются данными анамнеза и клинических проявлений болезни, а также выявлением ДНК ВПГ методом ПЦР в отделяемом из высыпаний, когда диагноз из-за локализации поражений или анамнестических данных вызывает сомнения.
В ряде случаев генитальная локализация ГВИ трудно диагностируется. Только в 20% случаев диагноз верен. 20% пациентов – вирусоносители, которые никогда не имели клинических симптомов или признаков заболевания. Нередко при рецидивах ВПГ генитальной локализации, протекающего в атипичной форме (без выраженных клинических признаков), диагноз кандидоза ошибочен. И наоборот: при заболеваниях, протекающих с язвенными поражениями (сифилисе, болезни Бехчета и др.), ставят диагноз герпеса.
Положительные результаты исследования методом ПЦР подтверждают наличие у пациента генитального герпеса, требующего лечения. Отрицательный результат теста не исключает диагноз, поскольку недостаточное количество материала, его потери при транспортировке в лабораторию и быстрое заживление очага инфекции способны привести к ложноотрицательному результату. В таких ситуациях исследование проводится два-три раза с интервалом две – четыре недели [4].
Полностью элиминировать вирус герпеса из организма не представляется возможным. Поэтому терапия герпетической инфекции направлена на блокаду репродукции вируса.
Противовирусная терапия наиболее эффективна в фазе репликации вируса. При обострении хронической инфекции, вызванной ВПГ, показана противовирусная терапия в комбинации с иммунопрепаратами на фоне патогенетической и симптоматической терапии.
Этиотропная терапия ГВИ считается общепризнанным подходом к лечению острых проявлений инфекции и профилактике ее обострений. Современные этиотропные противогерпетические препараты (ацикловир, валацикловир, фамцикловир) по уровню доказательности относятся к группе A [5]. Молекула валацикловира по сравнению с таковой ацикловира характеризуется более высокой биодоступностью (54%) и длительностью полувыведения (10–20 часов). Это позволяет снизить кратность приема препарата до двух раз в сутки и увеличить приверженность пациентов терапии.
Механизм действия противогерпетических препаратов заключается в угнетении синтеза вирусной ДНК и репликации вирусов за счет конкурентного ингибирования вирусной ДНК-полимеразы.
Последнее время на российском фармацевтическом рынке появляется большое количество препаратов валацикловира. Форма выпуска – таблетки, покрытые пленочной оболочкой, в стандартной дозе 500 мг (валацикловира гидрохлорида гидрат 611,70 мг), а также в дозе 1000 мг (валацикловира гидрохлорида гидрат 1223,40 мг). Клиническую эффективность валацикловира у пациентов с хронической рецидивирующей ГВИ изучали в исследовании [6].
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (при необходимости, обострениях ГВИ) и пролонгированная терапия. В первом случае препарат назначают коротким курсом 5–10 дней, во втором пациенты принимают препарат ежедневно в течение нескольких месяцев или лет не только для купирования данного рецидива, но и для профилактики последующих обострений [7–9].
Показаниями для назначения супрессивной терапии являются:
У пациентов с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные, общеукрепляющие средства). Как правило, таким пациентам показаны длительные курсы противовирусных препаратов (в частности, ацикловир, валацикловир, фамцикловир) [10].
При использовании супрессивной схемы лечения дозы препаратов зависят от клинического течения рецидивов генитального герпеса. Если количество рецидивов не более десяти в год, суточная доза валацикловира составляет 500 мг. При количестве рецидивов свыше десяти в год валацикловир используют в дозе 1000 мг.
В лечении ГВИ легкого и среднетяжелого течения широко используются иммуномодулирующие препараты, интерфероны (ИФН), индукторы интерферона, а также витаминотерапия. При тяжелых формах ГВИ целесообразно внутривенное введение иммуноглобулина.
При тяжелом и длительном течении ВПГ-инфекции в случае курсового использования названных препаратов в качестве монотерапии отмечается недостаточный клинический эффект. При длительном приеме развиваются побочные и нежелательные эффекты. ИФН представляет собой только часть противовирусной защиты иммунной системы и не может заменить другие ее звенья при их несостоятельности. Использование иммунокорректоров без оценки иммунного статуса, индивидуального подбора и контроля их действия бывает малоэффективно или способно приводить к усилению иммунной дисфункции либо гипореактивности ряда звеньев иммунитета вследствие неадекватной стимуляции. Назначение препаратов для местного применения (мази, содержащие ацикловир, Эпиген интим спрей (глицирризиновая кислота) и др.) носит вспомогательный характер, поскольку пузырьковые высыпания на коже лишь одно из проявлений тяжелой ВПГ-инфекции.
Как показывают данные литературы и накопленный нами опыт, вирус герпеса способен реплицировать в других клетках и органах (в орофарингеальной области, лимфоузлах, слизистой прямой кишки и т.д.).
К врачу аллергологу-иммунологу обратилась пациентка М. 32 лет с жалобами на пузырьковые высыпания на слизистой оболочке красной каймы губ, болезненность в области высыпаний, головную боль, нарушение сна, утомляемость, раздражительность.
Анамнез заболевания. Аналогичные симптомы беспокоят в течение пяти лет. Высыпания локализуются в области носогубного треугольника. Частота рецидивов – от шести до восьми раз в год. В течение полугода обострения ежемесячные. В 2013 и 2015 гг. – два эпизода герпетического кератита (заключение офтальмолога на руках). Неоднократно обращалась к дерматологу по месту жительства – курсы ацикловира 200 мг пять раз в сутки в течение трех – пяти дней с кратковременным эффектом. Кроме того, использовалась местная противовирусная терапия в виде мазей. Настоящее обострение в течение трех дней связывает со стрессом на работе (полгода работает на новом месте, рабочий график ненормированный). Самостоятельно применяла местную терапию без значимого эффекта.
Объективно. Состояние удовлетворительное. Температура тела 36,7 ºС.
На слизистой оболочке красной каймы верхней губы слева сгруппированные пузырьковые высыпания с серозным содержимым, желтоватые корочки, мокнутие.
Лабораторная диагностика. Выявлена ДНК ВПГ 1-го типа методом ПЦР из содержимого везикулы.
Консультация невролога. Астеноневротический синдром. Назначен Атаракс 25 мг по 1/2 таблетки на ночь в течение трех недель. Соблюдение режима труда и отдыха. Во время повторной консультации принято решение об отмене препарата.
Консультация оториноларинголога. Хронический тонзиллит, простая форма, стадия ремиссии. Рекомендован курс промывания лакун миндалин № 10.
Пациентке рекомендована супрессивная терапия препаратом валацикловир 1000 мг один раз в сутки шесть месяцев. Соблюдение указаний невролога, оториноларинголога. Повторная консультация через два с половиной – три месяца.
Пациентка повторно явилась на прием через три месяца. Жалоб не предъявляла. На фоне проводимого лечения рецидивов ГВИ не отмечалось. Со слов больной, стрессовый фон на работе уменьшился, сон нормализовался (отменила Атаракс месяц назад).
Через два месяца после завершения курса супрессивной терапии жалобы отсутствовали. Рецидивов ГВИ не наблюдалось.
ВЫБОР АНТИМИКРОБНЫХ ХИМИОПРЕПАРАТОВ ПРИ ВИРУСНЫХ ИНФЕКЦИЯХ. ГЕРПЕТИЧЕСКИЕ ИНФЕКЦИИ.
Герпетические инфекции представляют собой группу инфекционных заболеваний, вызываемых вирусами герпеса человека. Установлено, что среди обширного семейства герпесов только 6 типов вызывают различные заболевания человека:
Вирусы герпеса, кроме varicella-zoster, передаются преимущественно при контакте жидкостей тела носителя (кровь, слюна, сперма, секрет слизистых) с чувствительными участками тела неинфицированного человека. Это осуществляется контактным (в том числе половым) и трансфузионным путями, а также при трансплантации органов.
Вирус varicella-zoster передается воздушно-капельным путем. В дальнейшем вирус распространяется внутри организма гематогенным, лимфогенным и нейрогенным путями, инфицирует сенсорные ганглии вегетативной нервной системы, что практически обеспечивает его пожизненную персистенцию в организме человека. Это обстоятельство во многом определяет хроническое рецидивирующее течение инфекции, влияет на характер назначаемого лечения и его результаты.
Попытки одновременного применения иммуномодуляторов, индукторов интерферона, гормонов тимуса, адаптогенов и т.п. с целью активизации факторов иммунной защиты и повышения эффективности лечения лишены серьезных оснований. Нет ни одного исследования, выполненного в рамках доказательной медицины, свидетельствующего о положительном влиянии подобного рода «сопутствующей» терапии.
Несмотря на многочисленные и длительные исследования, до сих пор не получено эффективной профилактической вакцины против герпесвирусов, за исключением вируса varicella-zoster. Локальный характер поражения и латентное течение инфекции без вирусемии приводят к тому, что даже успешная выработка антител не предотвращает очередного рецидива.
Местное лечение очагов поражения наружными формами специфических препаратов возможно лишь при herpes labialis и, в сочетании с системным введением, при герпетическом кератите. При его осуществлении в продромальном периоде или сразу после первичных проявлений длительность обострения уменьшается и выраженность симптомов смягчается. В дополнение к специфическим препаратам целесообразно местное применение антисептиков при вторичной бактериальной инфекции, что способствует более быстрой эпителизации эрозивно-язвенных поражений.
ОРОФАЦИАЛЬНЫЙ ГЕРПЕС
Орофациальный герпес чаще вызывается ВПГ-1. Первичный эпизод обычно протекает в виде гингивостоматита и фарингита, рецидивы, как правило, в виде herpes labialis.
Выбор антимикробных препаратов
Лечение первичного эпизода проводится одним из противогерпетических ЛС для приема внутрь:
Лечение первичного эпизода можно продолжать до 10 и более дней, если не произошло заживление элементов.
При ограниченных очагах и редких рецидивах herpes labialis можно ограничиться только местным лечением, которое проводится 5% кремом ацикловира или 2% кремом пенцикловира. Эффективность терапии зависит от сроков ее начала. Терапию следует начинать при появлении первых признаков наступающего рецидива в виде легкого зуда, парестезий, покраснения или в течение первых суток после появления пузырьковых высыпаний. Крем наносят на очаги поражения 5-6 раз в сутки в течение 5-10 дней. При наличии вторичной бактериальной инфекции элементы обрабатываются антисептиками. Местное лечение можно сочетать с системным, в случаях обширных поражений и частых рецидивов. При этом используется один из нижеприведенных режимов терапии внутрь, которые обладают равной эффективностью:
ГЕНИТАЛЬНЫЙ ГЕРПЕС
Генитальный герпес вызывается обоими серотипами: ВПГ-1 (до 10%) и ВПГ-2 (90% случаев). Около 30% первичных эпизодов заболевания ассоциированы с ВПГ-1, однако число рецидивов значительно больше в случаях инфицирования ВПГ-2. Поэтому идентификация типов ВПГ имеет определенное значение для прогнозирования течения заболевания.
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
Специфическое лечение необходимо начинать как можно раньше после появления первых симптомов заболевания. Системная противовирусная химиотерапия позволяет добиться исчезновения клинических проявлений первичного эпизода или рецидива инфекции, а также предупредить их появление при условии начала лечения в продромальном периоде или в течение 1 сут после появления клинических признаков герпеса. Однако она не приводит к эрадикации вируса и не всегда влияет на частоту, тяжесть и риск развития рецидивов в последующем.
Существуют следующие подходы к системной противовирусной терапии генитального герпеса:
ПЕРВИЧНЫЙ ЭПИЗОД ГЕНИТАЛЬНОГО ГЕРПЕСА
Выбор антимикробных препаратов
Препараты выбора: ацикловир внутрь 0,2 г x 5 раз в сутки; ацикловир внутрь 0,4 г каждые 8 ч; ацикловир внутрь 0,8 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,25 г каждые 8 ч.
Длительность терапии: 5 дней
Лечение первичного эпизода можно продолжать до 10 и более дней, если не произошло заживление элементов.
При первичном эпизоде герпетического проктита суточная доза ацикловира должна быть увеличена (внутрь 0,4 г x 5 раз в сутки в течение 7-10 дней).
РЕЦИДИВИРУЮЩИЙ ГЕНИТАЛЬНЫЙ ГЕРПЕС
Выбор антимикробных препаратов
Препараты выбора: ацикловир внутрь 0,2 г х 5 раз в сутки; ацикловир внутрь 0,4 г каждые 8 ч; ацикловир внутрь 0,8 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,125 г каждые 12 ч.
Профилактическая (превентивная или супрессивная) терапия
Препараты выбора: ацикловир внутрь 0,4 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 24 ч; фамцикловир внутрь 0,25 г каждые 12 ч.
Профилактическая (превентивная или супрессивная) терапия показана при частоте обострений 6 и более эпизодов в год. Число рецидивов при этом уменьшается на 75% и более, облегчается их клиническое течение и улучшается психосексуальное самочувствие больных.
При рецидивировании чаще 10 раз в год возможно применение супрессивной терапии валацикловиром в дозе 0,25 г или 0,5 г каждые 12 ч. Существующий опыт применения супрессивной терапии показал ее эффективность и безопасность. Длительность курса составляет от 3-6 мес до 1 года и более.
После 1 года такого лечения необходимо по желанию пациента делать перерывы для оценки естественного течения заболевания. При этом достаточно наблюдение в течение как минимум 2 обострений.
Так как заражение возможно при отсутствии симптомов заболевания, то пациентам рекомендуется использовать барьерные методы контрацепции (мужские и женские презервативы) при всех половых контактах со здоровыми партнерами.
Влияние супрессивной терапии на уменьшение асимптоматического выделения вируса и, соответственно, уменьшение риска передачи вируса продолжает изучаться.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕНИТАЛЬНОГО ГЕРПЕСА У БЕРЕМЕННЫХ И НОВОРОЖДЕННЫХ
Безопасность системной терапии беременных ацикловиром, валацикловиром и фамцикловиром полностью не доказана. Назначение ацикловира беременным во время I триместра не повышает риск возникновения врожденных дефектов, по сравнению со средним уровнем в популяции. Результаты применения валацикловира и фамцикловира при беременности носят предварительный характер и не могут быть основанием для их регулярного использования.
Ацикловир может с осторожностью применяться беременными внутрь в дозах, указанных выше, как во время первичного эпизода, так и при рецидивах герпеса.
При наличии у беременной симптомов генитального герпеса накануне или у роженицы во время родов показано кесарево сечение. Однако при герпетическом поражении шейки матки и безводном промежутке более 4-6 ч оперативное родоразрешение не предупреждает заражение новорожденного.
Применение беременным с рецидивирующим генитальным герпесом супрессивной терапии ацикловиром (0,4 г каждые 12 ч) за 4 нед до предполагаемого срока родов может предотвратить обострение и, таким образом, позволить родоразрешение через естественные родовые пути.
Несмотря на все профилактические меры нельзя полностью исключить возможность заражения новорожденных, поэтому необходимо тщательное наблюдение за ними.
При наличии признаков герпеса лечение новорожденных проводится незамедлительно ацикловиром в/в 30-60 мг/кг/сут в 3 введения в течение 21 дня.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕНИТАЛЬНОГО ГЕРПЕСА У ПАЦИЕНТОВ С ИММУНОДЕФИЦИТОМ И ВИЧ-ИНФИЦИРОВАННЫХ
Поражения, вызванные ВПГ у пациентов с иммунодефицитными состояниями (ВИЧ, лучевая, химиотерапия и др.), встречаются довольно часто и характеризуются тяжелым и нередко атипичным течением.
Выбор антимикробных препаратов
Эпизодическая терапия рецидивов
Препараты выбора: ацикловир внутрь 0,4 г ґ 5 раз в сутки; валацикловир внутрь 1 г каждые 12 ч; фамцикловир внутрь 0,5 г каждые 12 ч.
Длительность терапии: 5-10 дней.
Препараты выбора: ацикловир внутрь 0,4-0,8 г каждые 8-12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,5 г каждые 12 ч.
При тяжелом течении эпизодов, а также при осложненной форме (диссеминированная инфекция, пневмония, гепатит, менингит, энцефалит и др.) как при отсутствии, так и при наличии иммунодефицитного состояния, необходимо в/в введение ацикловира в дозе 5 мг/кг/сут в течение 5-7 дней или до выздоровления.
При отсутствии эффекта от максимальных доз ацикловира возможно обнаружение ацикловирорезистентных штаммов ВПГ, которые также устойчивы к валацикловиру и фамцикловиру. В этих случаях рекомендуется фоскарнет (в России не зарегистрирован) в/в 0,04 мг/кг каждые 8 ч до ликвидации клинических проявлений.
Местное лечение генитального герпеса наружными формами противогерпетических препаратов неэффективно. При присоединении вторичной бактериальной инфекции, пораженные участки обрабатываются антисептиками.
ИНФЕКЦИИ, ВЫЗЫВАЕМЫЕ ВИРУСОМ varicella-zoster
Ветряная оспа представляет собой первичную инфекцию, вызываемую вирусом varicella-zoster. У детей (90% заболевания встречается до 13 лет) заболевание протекает относительно легко, у взрослых может осложниться энцефалитом и пневмонией.
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
Протигерпетические препараты используются для лечения обоих заболеваний. Они укорачивают период высыпаний на коже в среднем на один день, уменьшают число новых кожных элементов примерно на 25% и ослабляют выраженность общих симптомов у трети пациентов. Специфическое лечение необходимо начинать в первые сутки после начала заболевания. При опоясывающем лишае системная противовирусная терапия ускоряет заживление кожных элементов и уменьшает частоту острого неврита.
У детей 2-16 лет применяют ацикловир внутрь 20 мг/кг (но не более 0,8 г) каждые 6 ч в течение 5 дней.
У взрослых используют следующие режимы лечения:
Заместительная и супрессивная терапия в практике эндокринолога
Е.А. Трошина, Н.В.Мазурина, Е.М.Скрынник
ФГУ Эндокринологический научный центр МЗСР РФ, Москва
Препараты тиреоидных гормонов относятся к числу наиболее часто используемых в клинической практике лекарственных средств. Их назначают с целью проведения заместительной или супрессивной терапии при ряде заболеваний щитовидной железы (ЩЖ).
Целью заместительной терапии является поддержание нормального обмена веществ у больных гипотиреозом любой этиологии.
Манифестный гипотиреоз
Левотироксин назначают из расчета 1,6–1,8 мкг на 1 кг массы тела (ориентировочная начальная доза для женщин 75–100 мкг/сут; мужчин – 100–150 мкг/сут).
Целевое значение тиреотропного гормона (ТТГ) при проведении заместительной терапии левотироксином первичного гипотиреоза составляет 0,5–1,5 мМЕ/л.
При проведении заместительной терапии центрального (вторичного) гипотиреоза необходимо добиться поддержания тироксина крови на уровне, соответствующем верхней трети нормальных значений для этого показателя.
Субклинический гипотиреоз
Тироксин назначают из расчета 1 мкг на 1 кг массы тела (ориентировочная начальная доза 50–75 мкг/сут).
Целью супрессивной терапии также является достижение концентрации ТТГ менее нижней границы нормы для предотвращения его возможного стимулирующего влияния на рост ткани ЩЖ (в том числе на рост резидуальной опухолевой ткани).
Целевое значение ТТГ составляет менее 0,1 мМЕ/л. Для этого используются дозы левотироксина от 2,2 до 2,5 мкг на 1 кг массы тела в сутки.
Принципы заместительной терапии левотироксином
Изменения секреции тиреоидных гормонов и снижение функции ЩЖ (гипотиреоз) могут происходить в результате поломки биосинтеза тиреоидных гормонов на разных его этапах: поступления йодида из крови, окисления его в элементарный йод, включения йода в состав тирозинов с образованием монойодтирозина и дийодтирозина, конденсации молекул йодтирозина с образованием Т4 и Т3. Независимо от того, на какой из стадий произошло нарушение метаболизма гормонов ЩЖ, будут изменяться те физиологические эффекты, за которые ответственны тиреоидные гормоны.
Основные физиологические эффекты тиреоидных гормонов:
• регуляция энергетического обмена
• регуляция роста и развития
• регуляция белкового, углеводного и жирового обмена
• влияние на сердечно-сосудистую систему
• влияние на костно-мышечную систему
• влияние на психику
Лечение всех форм гипотиреоза является заместительным и пожизненным. Исключение составляет только гипотиреоз, вызванный введением каких-либо медикаментов или веществ, блокирующих выработку тиреоидных гормонов.
Препараты левотироксина являются препаратами выбора для заместительной терапии гипотиреоза, и представляют собой синтетический тироксин (натриевая соль тироксина), который полностью идентичен тироксину, продуцируемому ЩЖ. Хорошо всасывается в желудочно-кишечного тракта (ЖКТ), причем при гипотиреозе его всасывание не нарушено.
Один из препаратов левотироксина – Эутирокс (фирма «Никомед»). Его отличием от других препаратов этой группы является возможность с легкостью подобрать нужную дозировку – 25, 50, 75, 100, 125 или 150 мкг, что существенно облегчает проведение как заместительной, так и супрессивной терапии.
На фоне заместительной терапии Эутироксом концентрация Т3 сохраняется постоянной. Режим дозирования препарата устанавливают индивидуально, с учетом тех возможных ситуаций, когда потребность в тироксине может изменяться (табл. 1).
Таблица 1. Ситуации, при которых может измениться потребность организма в тироксине
| Повышение потребности в тироксине | |
| • Снижение абсорбции в кишечнике (заболевания слизистой оболочки тонкой кишки и после операций на тонкой кишке) | |
| • Поносы при диабете | |
| • Цирроз печени | |
| • Беременность | |
| • Прием препаратов, снижающих абсорбцию | |
| Холестирамин Сукралфат Окись алюминия Сульфат железа | |
| • Препараты, увеличивающие выведение неметаболизированного Т4 | |
| Рифампицин Карбамазепин Возможно, фенитоин | |
| • Препараты, блокирующие конверсию Т4 в Т3 | |
| Амиодарон Дефицит селена | |
| Снижение потребности в тироксине | |
| • Пожилой возраст | |
| • Ожирение | |
Поскольку основной задачей лечения гипотиреоза является восстановление нормальных физиологических функций всех органов и систем, нарушенных вследствие гипотиреоза, то и при первичном, и при вторичном (третичном) гипотиреозе основа лечения – адекватная заместительная терапия препаратами тиреоидных гормонов. Критерием адекватности лечения служит исчезновение клинических и лабораторных проявлений гипотиреоза.
Компенсация манифестного гипотиреоза – 1,6–1,8 мкг левотироксина в сутки. Средняя суточная доза 75–150 мкг
Компенсация субклинического гипотиреоза – 1 мкг левотироксина на 1 кг массы тела. Средняя суточная доза 50–75 мкг
Терапию начинают с небольшой дозы Эутирокса, причем у пожилых она может составлять 12,5 мкг/сут. Препарат принимают утром, натощак. Дозу постепенно увеличивают до поддерживающей (у молодых больных за 4 нед, у пожилых за 2 мес, а иногда, при наличии сопутствующей кардиальной патологии, за 3–4 мес).
Оценивать уровень ТТГ на фоне лечения следует не раньше чем через 2 мес от начала терапии. Далее исследовать этот показатель нужно с интервалом 1 раз в 6 мес и корректировать дозу Эутирокса в зависимости от полученных результатов.
При лечении вторичного гипотиреоза схема назначения препарата аналогичная, однако контролировать, по понятным причинам, следует не ТТГ, а свободный Т4. В табл.2 представлен начальный этап лечения гипотиреоза.
Таблица 2. Начальный этап заместительной терапии у больных гипотиреозом
| Больные без кардиальной патологии моложе 65 лет |
| Левотироксин назначают из расчета 1,6–1,8 мкг на 1 кг массы тела |
| Ориентировочная начальная доза: |
| • женщины – 50–75 мкг/сут |
| • мужчины – 75–100 мкг/сут |
Больные с кардиальной патологией и/или старше 65 лет
Начальная доза 12,5 мкг левотироксина в день (увеличивать по 12,5 мкг с интервалом 2 мес до нормализации уровня ТТГ, при появлении или ухудшении кардиальных симптомов провести коррекцию терапии).
Тяжесть и длительность гипотиреоза являются основными критериями, определяющими тактику врача в момент начала лечения.
Чем тяжелее гипотиреоз и чем дольше он был некомпенсирован, тем выше будет общая восприимчивость организма к тиреоидным гормонам, особенно это относится к кардиомиоцитам. Поэтому процесс адаптации к препарату должен быть постепенным и плавным независимо от возраста пациента.
При назначении тироксина пациенту с гипотиреозом нужно выяснить, какие еще медикаменты он получает, поскольку многие препараты могут увеличивать потребность в тироксине. Если не учитывать этот эффект, компенсация гипотиреоза может быть затруднена.
Субклинический гипотиреоз характеризуется отсутствием четких клинических проявлений заболевания. Жалобы пациента, как правило, неспецифичны и часто сводятся к повышенной слабости и утомляемости. Лабораторные параметры включают в себя незначительное повышение ТТГ при нормальных уровнях Т3 и Т4. Нередко субклинический гипотиреоз является случайной находкой при общем обследовании больного. Данный синдром чаще обнаруживается у пожилых пациентов.
Для верификации диагноза нужно провести больному повторное определение уровня ТТГ через 6 мес. В том случае, если у пациента регистрируется стойкое повышение уровня ТТГ, вопрос о лечении следует решать в индивидуальном порядке. Однозначного мнения по поводу целесообразности специфической терапии субклинического гипотиреоза в настоящее время нет. Но если такая терапия проводится, то она должна сопровождаться адекватным и своевременным наблюдением за пациентом, включающим в себя определение уровня ТТГ. Как правило, заместительную терапию при субклиническом гипотиреозе начинают тогда, когда уровень ТТГ составляет 10 мЕ/л и выше, и Эутирокс назначают в дозе 1 мкг на 1 кг массы тела (суточная доза составляет 50–75 мкг).
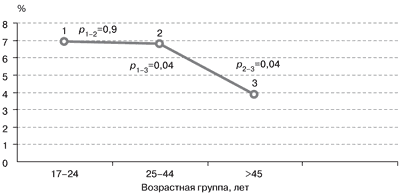
| Рис. 1. Распространенность ДЗ в различных возрастных группах. |
 |
Гипотиреоз и беременность
При некомпенсированном гипотиреозе наступление беременности крайне маловероятно. Если беременность все же наступила, то лечение гипотиреоза должно быть начато немедленно. Во время беременности потребность в левотироксине в среднем возрастает на 45% от расчетной исходной дозы. Если беременность наступила у женщины с компенсированным гипотиреозом, то доза препарата должна быть увеличена в соответствии с возросшей потребностью в нем.
Принципы супрессивной терапии левотироксином
Высокодифференцированный рак ЩЖ (ВДРЩЖ)
На протяжении многих лет основным способом терапии для больных, получивших радикальное лечение по поводу ВДРЩЖ, остается введение тиреоидных гормонов в дозах, превышающих физиологические (2,5 мкг на 1 кг массы тела в сутки), с целью снижения концентрации сывороточного ТТГ. Клетки рака ЩЖ, происходящие из фолликулярного эпителия, имеют рецепторы ТТГ, и в ответ на их стимуляцию происходит повышение активности аденилатциклазы. Предполагается, что эти опухоли ЩЖ могут расти под воздействием ТТГ. Многие исследователи отмечали уменьшение частоты рецидивов опухолевого роста благодаря подавлению секреции ТТГ под воздействием супрессивной терапии как при папиллярной, так и при фолликулярной тиреоидной карциноме.
Сегодня рекомендуется использовать методы анализа ТТГ III поколения, которые позволяют выявлять его присутствие в сыворотке в концентрациях порядка 0,01 мЕд/л.
До сих пор активно обсуждается вопрос о том, что более опасно для пациента: предотвращение рецидива рака при условии поддержания субклинического тиреотоксикоза или неблагоприятное влияние медикаментозного тиреотоксикоза на сердце и кости. Побочные эффекты супрессивных доз левотироксина включают нарушения контрактильности миокарда, увеличение частоты сердечных сокращений и предсердные аритмии, а также могут вызывать ускорение круговорота элементов костной ткани, остеопороз. По этой причине многие специалисты считают, что полное подавление секреции гипофизарного ТТГ на протяжении длительного периода (до 0,01–0,1 мЕд/л или ниже) целесообразно лишь у больных, входящих в группу высокого риска – в первую очередь при повышенной вероятности рецидивов или смерти у пациентов с ВДРЩЖ. В то же время большинство клиницистов полагают, что у подавляющего числа больных с папиллярной тиреоидной карциномой, относимых к группе низкого риска на основании результатов прогностической балльной оценки, хороший эффект дает относительно слабое подавление секреции ТТГ. У таких больных концентрацию сывороточного ТТГ следует поддерживать на уровне 0,1–0,4 мЕд/л. В целом при лечении ВДРЩЖ, по имеющимся на сегодняшний день данным контролируемых исследований, назначение высоких доз левотироксина с целью подавления уровня ТТГ имеет преимущества по сравнению с обычной заместительной терапией, при которой поддерживается эутиреоз, т.е. нормальный уровень ТТГ. Исключение могут составлять пожилые больные или больные с тяжелым заболеванием сердца и выраженным остеопорозом.
Узловой коллоидный зоб
В настоящее время в соответствии с Консенсусом РАЭ решение вопроса о целесообразности супрессивной терапии левотироксином при узловом коллоидном зобе определяется в индивидуальном порядке. Лечение препаратами тироксина наиболее эффективно при солитарных коллоидных узлах паренхиматозного типа строения, сочетающихся с увеличением ЩЖ и/или наличием в ткани железы зобных изменений, определяемых при ультразвуковом исследовании(УЗИ).
Левотироксин в лечении диффузного нетоксического зоба
Диффузный нетоксический зоб
Диффузный нетоксический зоб – общее диффузное увеличение щитовидной железы без нарушения ее функции. Основной причиной диффузного зоба является недостаточное содержание йода в окружающей среде и как следствие сниженное его потребление населением с привычными продуктами питания. В зависимости от распространенности диффузного зоба (ДЗ) в популяции различают спорадический и эндемический зоб. Зоб считается эндемическим, если в обследуемом регионе частота встречаемости зоба у детей младшего и среднего школьного возраста составляет более 5%. Хотя в подавляющем большинстве случаев причиной ДЗ является недостаточное поступление в организм человека йода, ряд закономерностей позволяет предположить о влияние генетических факторов на его формирование. Обращает на себя внимание тот факт, что в одном и том же регионе при одном и том же йодном обеспечении зоб определяется не у всего населения, а лишь у части. Важность генетических факторов подтверждена многими популяционными, семейными и близнецовыми исследованиями. Кроме того, при ДЗ выявлены некоторые мутации в таких генах, как ТРО, NIS, TG, TSHR.
Известно, что распространенность любых форм зоба в популяции существенно различается в зависимости от возраста. Считается, что ДЗ как первая стадия йододефицитного заболевания чаще встречается у молодых людей. Этот факт нашел свое подтверждение и на территории Москвы – зоны легкого йодного дефицита, при сравнении частоты встречаемости ДЗ в различных возрастных группах взрослого населения (рис. 1).
ДЗ достоверно чаще встречался у лиц моложе 45 лет.
Хотя пациенты с ДЗ, как правило, не предъявляют жалоб, функция ЩЖ у них не нарушена, они все же нуждаются в лечении данного заболевания, поскольку оно является первой фазой(обратимой при правильном лечении) формирования узлового и многоузлового йододефицитного зоба, в том числе и с развитием синдрома тиреотоксикоза на поздних стадиях процесса.
На сегодняшний день существует три варианта консервативной терапии ДЗ:
Как было сказано, назначение левотироксина широко применялось для лечения эутиреоидного ДЗ в прошлом. При этом на начальном этапе достигались отличные результаты. Во многих клинических исследованиях было показано, что уже через 3–4 мес от начала терапии происходило значительное (не менее 20%) уменьшение объема железы. Чаще же всего в клинической практике использовались дозы 150 мкг у взрослых и 100 мкг у подростков. Однако в многочисленных работах однозначно продемонстрирован «феномен отмены» – увеличение размеров ЩЖ почти до исходного уровня через короткое время после прекращения лечения. Данный феномен объясняется прежде всего тем, что при подавлении ТТГ снижается активность Na-I симпортера, а следовательно, уменьшается активный захват йода ЩЖ. На фоне резкого падения интратиреоидного содержания йода при отмене лекарственного препарата происходит новый рост железы. Также к нежелательным побочным явлениям терапии гормонами ЩЖ относят возможное возникновение лекарственного тиреотоксикоза, тахиаритмии, остеопороза, что ограничивает использование этой группы препаратов при длительном лечении ДЗ. Однако иногда для быстрого достижения терапевтического эффекта прибегают к кратковременному курсу лечения ДЗ Эутироксом с дальнейшим переходом на поддерживающую терапию Йодбалансом.
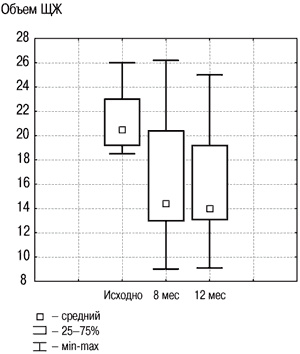
Рис. 2. Динамика объема ЩЖ в группе «Монотерапия препаратом йода» исходно, на 8 и 12-м месяце.
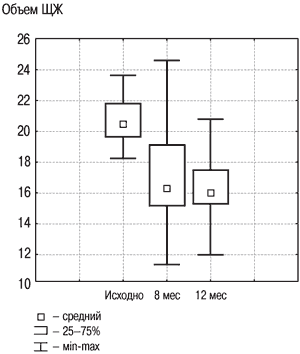
Рис. 3. Динамика объема ЩЖ в группе «Комбинированная терапия» исходно, на 8 и 12 месяце.
Таблица 3. Сравнение основных показателей между группами «Монотерапия» и «Комбинированная терапия» через 12 мес
| Показатель | Монотерапия | Комбинированная терапия | р (критерий) |
| Объем ЩЖ | 16,1 (13,1; 19,2) | 16,1 (15,2; 17,5) | 0,83 (Рм-у=0,21) |
| ТТГ | 0,9 (0,8; 1,1) | 1,2 (1; 1,48) | 0,07 (Рм-у=0,92) |
| АТ к ТПО*, % | 3 | 0 | 1 |
* – антитела к тиреоидной пероксидазе
Монотерапия препаратом йода и комбинированная терапия
Наиболее предпочтителен метод лечения ДЗ, являющийся этиологическим. Препараты йода назначают в физиологических дозировках (200 мкг в сутки) на 6 мес с последующей оценкой динамики объема ЩЖ.
При отсутствии выраженного эффекта от приема йодидов через 6 мес может быть рекомендован переход на комбинированную терапию. При этом предпочтение должно отдаваться либо фиксированной комбинации 75 мкг левотироксина +150 мкг йодида, либо индивидуально подобранной дозе Эутирокса из расчета 1 мкг на 1 кг массы тела в сочетании с 150 мкг йодида в сутки.
В настоящее время клиницисты имеют возможность использовать в этих целях комбинированные препараты, в состав которых входит как левотироксин, так и йод. Так, препарат Йодтирокс («Никомед») оптимально сочетает левотироксина натрий – 100 мкг и калия йодид – 100 мкг. Суточную дозу Йодтирокса принимают 1 раз в день утром, натощак, за 30 мин до завтрака, запивая таблетку небольшим количеством жидкости и не разжевывая.
Комбинированная терапия препаратами йода и тироксина, как было неоднократно показано, имеет ряд преимуществ. Во-первых, воздействуя на несколько патогенетических механизмов образования зоба, подавляется и гипертрофия, и гиперплазия тиреоцитов. Это позволяет добиться результатов, по эффективности сопоставимых с монотерапией тироксином (при гораздо меньшем его содержании), что в свою очередь уменьшает количество побочных эффектов, связанных с приемом тиреоидных препаратов. Во-вторых, снижается также склонность к «эффекту отмены» при кратковременном перерыве в лечении. В-третьих, менее выражено подавление уровня ТТГ, например по сравнению с эффектом тироксина в дозе 150 мкг.
Результаты исследования динамики объема ЩЖ у лиц с ДЗ на фоне разных схем терапии, проведенного в ФГУ ЭНЦ, представлены на рис. 2, 3. В целом по группе объем ЩЖ уменьшился на 20% к моменту завершения лечения, что явилось статистически значимым (р1–2
Литература