Стандарт качества gmp что это значит
Стандарт качества gmp что это значит
Международный стандарт GMP считается одним из основных в мире, определяющих требования к производству лекарственных средств, БАДов и даже продуктов питания.
Для чего предназначен стандарт?
Полное название этого набора требований – Good Manufacturing Practice for Medicinal Products, что в переводе означает «Правила производства медицинской продукции». Международный стандарт GMP имеет следующие цели:
1. Обеспечить высокий уровень качества продукции.
2. Гарантировать, что:
История возникновения
Начало стандарту было положено в США в 1963 году, когда появились на свет первые правила безопасного и качественного изготовления лекарственных средств. Стандартную форму официального документа, впрочем, они приняли лишь в 1968 году. А через год Всемирная организация здравоохранения (ВОЗ) рекомендовала всем странам применять международный стандарт GMP. Впоследствии эти правила неоднократно дополнялись и корректировались, пока не приняли нынешний вид.
Откровенно игнорировал стандарт на начальном этапе его внедрения лишь Советский Союз, Минздрав которого разработал свои нормы, по строгости иногда превышающие GMP. Интерес к международному стандарту начал проявляться лишь с 1991 года, когда начались процессы по импорту и экспорту лекарств. Однако на первых порах достичь гармонии столь различных правил не удавалось. Лишь с 90-х годов появились какие-то реальные подвижки.
Российский стандарт
Нормативная база на территории стран СНГ начала разрабатываться после распада СССР. Главная цель была – на основе прежних нормативов максимально сблизить два стандарта, постепенно приближаясь к правилам, которые определял GMP (международный стандарт качества).
Процесс оказался долгим. Только в 2001 году в РФ появился близкий международному стандарт. Он предусматривает, что с 01.07.2000 все создаваемые и реконструируемые предприятия по выпуску лекарств будут получать лицензии на производство, хранение и реализацию продукции только при условии соответствия российскому аналогу GMP.
Разработкой его занималась организация под названием Ассоциация инженеров по контролю микрозагрязнений (АСИНКОМ). Отечественные правила были утверждены 10.04.2004 Госстандартом РФ, в результате чего появился ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств». Он был введен в действие 01.01.2005, и считалось, что этот стандарт максимально сближен с международным. Однако с 01.01.2010 начал работать национальный российский стандарт GMP. Он взял за основу европейские правила, и прежний ГОСТ утратил актуальность.
Где в РФ расположены применяющие стандарт предприятия
Подавляющее большинство предприятий, которые получили сертификаты качества, соответствующие международным правилам, пока расположены в Москве, Санкт-Петербурге и других крупных промышленных и научных центрах страны.
Планируется полный перевод на GMP (международный стандарт) всех предприятий. Более того, он должен был закончиться еще в 2014 году, но возникло множество трудностей. Выяснилось, что далеко не каждое отечественное предприятие фармацевтической отрасли способно получить соответствующий сертификат качества. Главная проблема – нет кадров, имеющих достаточную теоретическую и, что особенно важно, практическую подготовку по внедрению стандарта на российской территории.
Основные элементы стандарта GMP
Стандарт GMP (Good Manufacturing Practice) предусматривает множество показателей, которым должны соответствовать производители продукции. Причем для фармацевтов детально регламентированы требования к каждому этапу изготовления – от концентрации бактерий, содержащихся в одном кубометре воздуха, до маркировки продукции.
В качестве примера можно привести требование к предприятию, изготавливающему лекарства в таблетках. В таких случаях GMP (международный стандарт) требует от организации «особо чистых цехов», в которых повышенная стерильность процесса достигается входными шлюзами для персонала, специальным режимом воздушной фильтрации и т. п. В России в таких цехах изготавливали лишь кремниевые кристаллы и особые микросхемы.
Какие условия нужны для перехода на стандарт?
Чтобы перевести российские предприятия на международный стандарт GMP, нужны и внешние, и внутренние условия. На государственном уровне требуется:
Чтобы выполнялся GMP-стандарт, правила GMP на уровне предприятий должны предусматривать следующие позиции:
Нужен ли стандарт для потребления лекарств внутри РФ?
При ответе на вопрос о том, нужен ли GMP (международный стандарт) в России, обычно рассматривается два аспекта.
1. С одной стороны, соблюдение его строжайших правил позволяет поднять планку качества лекарственных средств на очень высокий уровень. Население России тогда получит высокоэффективные и чистые лекарства, что позволит меньше болеть и скорее выздоравливать.
2. С другой стороны, отечественные предприятия финансово просто не «тянут» преобразования. Если же предприятие удается перевести на современные рельсы, то себестоимость лекарств существенно возрастает, и их реализация усложняется.
Оба эти фактора в России постоянно вступают в противоречие и тормозят внедрение стандарта. Впрочем, в связи с новыми геополитическими реалиями и необходимостью в импортозамещении лекарственных средств процесс должен в ближайшее время ускориться.
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
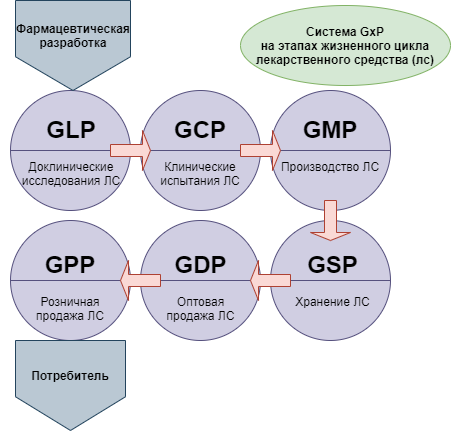
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
Принятие решения о выдаче заключения по результатам инспекционного отчета
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Смотри на упаковке: Что такое GMP и зачем обращать на это внимание при покупке лекарств?
Informburo.kz совместно с компанией SANTO рассказывает, зачем фармацевтическим компаниям нужен стандарт GMP, и что всё это значит для покупателя.
Покупая лекарства, хочется быть уверенным, что они помогут решить проблемы со здоровьем, ну или хотя бы, не навредят. Стандарт GMP – самая проверенная и надёжная система обеспечения качества фармацевтических препаратов в мире. Она гарантирует наилучшее качество продукта, его постоянную проверку и соответствие мировым стандартам производства.
№1. Что такое GMP?
GMP (Good Manufacturing Practice; Надлежащая производственная практика) – это международный стандарт, определяющий требования к производству лекарственных препаратов, БАДов, пищевых добавок и некоторых продуктов питания. В международный стандарт GMP включены все требования, которым должно отвечать предприятие-производитель: от температуры в производственном цехе до одежды работников. Стандарты GMP – это не просто пожелания к производству препаратов, а строгие требования. Употребляя лекарства или продукты компаний, имеющих сертификат GMP, потребитель может быть спокоен за своё здоровье.
№2. Зачем нужен этот стандарт, и чем он отличается от других?
GMP – принципиально новый подход к соблюдению технологий производства. Обычный контроль качества предполагает исследование только некоторых, причём уже готовых, образцов продукции и гарантирует лишь их качество или качество партии, выпущенной в то же время. По стандартам GMP производится комплексная лабораторная проверка и регулирование всех параметров производства, а значит – обеспечение качества всей продукции. Правила GMP вводятся, чтобы снизить риск ошибок на производстве до минимума.
№3. Какие правила есть в своде GMP?
Кроме GMP в мировой практике распространены и другие стандарты надлежащих практик исследования, производства, дистрибьюции, хранения и лекарственного обеспечения:
Читайте также:
№4. GMP – это какой-то новый тренд?
Нет, это не очередной скоропортящийся тренд. Мировая история GMP стандартов берёт своё начало с 1963 года в США, где группой ученых были разработаны специальные правила для регламентирования условий качественного и безопасного производства лекарственных препаратов – стандарт Good Manufacturing Practice (GMP). Начиная с 70 годов, GMP получил широкое распространение во всем мире, за исключением Советского Союза. Уже после распада СССР страны СНГ начали подстраивать существующие нормативные базы к правилам GMP.
№5. А Казахстан принял стандарт GMP?
Стандарты надлежащих фармацевтических практик, в том числе GMP, были утверждены в системе Госстандарта Республики Казахстан ещё в 2006 году. Тогда они носили рекомендательный, добровольный характер. Но уже с марта 2014 года все иностранные компании, экспортирующие продукцию в Казахстан, должны были подтвердить, что работают по стандарту GMP, иначе ввоз их продукции в страну запрещался. В 2015-м стандарты GMP актуализировали с учётом требований ЕС и ЕАЭС. С января 2016 года начал функционировать общий рынок лекарств для стран Евразийского экономического союза. На территории ЕАЭС должны производиться и распространяться только медицинские препараты стандарта GMP, который подтверждает эффективность, безопасность и качество продукции.
С 1 января 2018 года стандарты GMP сделали обязательными для казахстанских производителей. Те из них, кто ещё не внедрил GMP, могут подавать заявку на проведение оценки безопасности и качества продукции и реализовывать препараты до истечения сроков действия их регистрационных удостоверений.
№6. Какие производители имеют сертификат соответствия GMP?
Производители продукции, изготовление которой регламентировано стандартом GMP, должны пройти процедуру сертификации. Наличие сертификата GMP у производителя подтверждает, что:
Сертификаты GMP в Казахстане уже получили 58 предприятий. Одним из первых отечественных производителей, активно внедряющих этот стандарт, стала компания SANTO. Компания получила первый сертификат GMP по производству мягких лекарственных форм в 2011 году. В 2012-м SANTO получила сертификат GMP на производственный участок асептической рассыпки порошковых антибиотиков. В 2013-м – сертификат на действующий ампульный цех, в 2014-м – на производство инъекционных растворов в цехе по производству инъекционных растворов и инфузий. В 2015-м SANTO был выдан сертификат GMP на производственный участок инфузионных растворов, а в 2018-м – на производственные площадки по производству инъекционных растворов и инфузий, производству твёрдых пероральных лекарственных средств. Также SANTO – обладатель сертификата на соответствие аптечного склада стандарту надлежащей дистрибьютерской практики (GDP). Обладание такими сертификатами – веское подтверждение того, что система обеспечения качества и условия производства в компании отвечают правилам надлежащей производственной практики Республики Казахстан.
№7. Я пришёл в аптеку. Как узнать, что нужное мне лекарство произведено по правилам GMP?
Некоторые производители указывают это прямо на упаковке, ведь знак GMP – гарантия качества. Но даже если вы не нашли этой аббревиатуры на коробочке, важно помнить, что с 2014 года все иностранные лекарства, продающиеся в Казахстане, соответствуют GMP. Другие зарубежные лекарственные препараты в нашей стране не регистрируются.
Отечественные производители также постепенно внедряют стандарт в производство. Полный список компаний, уже имеющих сертификат соответствия GMP, можно посмотреть на сайте Министерства здравоохранения РК.
Читайте также:
№8. В Казахстане производят много лекарств?
Да, в Казахстане производят многие лекарства. Всего на казахстанском фармацевтическом рынке представлено больше 700 компаний. Один из лидеров казахстанской фарминдустрии – компания SANTO – производит более 200 генерических препаратов и оригинальных лекарственных препаратов 12 фармакологических групп. Производственные мощности компании позволяют ежегодно выпускать 1 млрд. 283 млн. таблеток, капсул и гранул, 294 млн. ампул, 6 млн. инфузий, 40 млн флаконов порошков антибиотиков (цефалоспорины ) и 13 млн. флаконов порошков антибиотиков (пенемы/мицины) и 4,5 млн. флаконов жидких пероральных лекарственных средств. 90% продукции реализуется на внутреннем рынке страны, 10% экспортируется в Россию, Кыргызстан, Таджикистан, Монголию и Туркменистан.
№9. Как GMP влияет на казахстанскую фармацевтическую индустрию?
Внедрение GMP гарантирует обычным покупателям, что отечественные препараты ничем не уступают иностранным, потому что произведены по единому стандарту. Подтверждение стандартов способствует более свободному продвижению казахстанских препаратов на внешних рынках. По данным Казахстанского института развития индустрии за 2017 год в Казахстане было произведено фармацевтической продукции на 73,4 млрд тенге. На три региона – Южно-Казахстанскую и Алматинскую области и город Алматы – пришлось 92,3% прибыли от произведённой продукции. Старейшее предприятие ЮКО – АО «Химфарм» с торговой маркой SANTO – лидер среди казахстанских производителей лекарственных средств и часть международной фармацевтической группы Polpharma. Это одно из первых казахстанских предприятий, которое подтвердило соответствие государственному стандарту Надлежащей производственной практики (GMP) и получило сертификаты соответствия.
Стандарт качества gmp что это значит
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Good manufacturing practice for medicinal products (GMP)
____________________________________________________________________
Текст Сравнения ГОСТ Р 52249-2009 с ГОСТ Р 52249-2004 см. по ссылке.
— Примечание изготовителя базы данных.
____________________________________________________________________
Дата введения 2010-01-01
Сведения о стандарте
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ) на основе собственного аутентичного перевода Правил, указанных в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 «Производство и контроль качества лекарственных средств»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 20 мая 2009 г. N 159-ст
4 Настоящий стандарт идентичен Правилам производства лекарственных средств для человека и животных Европейского Союза (ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use) по состоянию на 31.01.2009 г., за исключением приложения 20.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, указанные в разделе «Сведения о соответствии ссылочных международных стандартов национальным стандартам»
Настоящий стандарт является идентичным переводом правил GMP Европейского Союза (GMP ЕС) «Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use» по состоянию на 31 января 2009 г.
Впервые правила GMP ЕС были приняты в России в 2004 г. в качестве ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств», который соответствовал правилам GMP ЕС 2003 г. За истекшее время в правила GMP ЕС внесены следующие существенные изменения и дополнения:
— добавлены новые требования в основной текст;
— внесены изменения в:
— приложение 1 Производство стерильных лекарственных средств;
— приложение 3 Производство радиофармацевтических препаратов;
— приложение 7 Производство лекарственных средств из растительного сырья;
— приложение 13 Производство лекарственных средств для исследований;
— введены два новых приложения:
— приложение 19 Контрольные и архивные образцы;
— приложение 20 Анализ рисков для качества;
— внесен ряд других изменений.
Также была изменена структура данного стандарта. В ГОСТ Р 52249-2004 приложение 18 содержало «Руководство по производству активных фармацевтических субстанций (АФС)», что соответствовало Правилам GMP ЕС на 2003 г. В новой редакции правил GMP ЕС требования к производству АФС перенесены из приложения в основную часть, которая содержит теперь две части:
— часть I Основные требования и
— часть II Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов.
Приложение 18 отсутствует, хотя сохранен его номер. Такой порядок структуры стандарта сохранен и в ГОСТ Р 52249-2009.
В последнюю редакцию правил GMP ЕС введено приложение 20 об анализе рисков, являющееся текстом руководства ICH Q9 «Анализ рисков для качества» (Quality Risk Management). Этот текст изложен неконкретно и непригоден к практическому применению. В связи с этим приложение 20 в текст нового стандарта не включено, о чем указано в сносках в тексте стандарта, выделенных курсивом.
По тексту стандарта опущены ссылки на Директивы ЕС, содержащиеся в оригинале правил GMP ЕС.
Область применения
Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных.
Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций (часть II) и отдельных видов лекарственных средств (приложения 1-19).
Стандарт не устанавливает требований к обеспечению промышленной безопасности, пожарной безопасности, взрывобезопасности, химической безопасности и безопасности других видов при производстве лекарственных средств.
Часть I
1 Организация работы по обеспечению качества
Производитель лекарственных средств должен организовать их производство так, чтобы лекарственные средства гарантированно соответствовали своему назначению и предъявляемым к ним требованиям и не создавали риска для потребителей из-за нарушения условий безопасности, качества или эффективности. Ответственность за выполнение этих требований несут руководители и все работники предприятия-производителя, а также поставщики и дистрибьюторы.
Для достижения этой цели на предприятии-производителе на основе настоящего стандарта (правил GMP) должна быть создана система обеспечения качества, включающая в себя организацию работы по GMP, контроль качества и систему анализа рисков.
Должны быть документально оформлены в полном объеме требования к системе обеспечения качества и организован контроль эффективности ее функционирования. Все звенья этой системы следует укомплектовать квалифицированным персоналом, обеспечить необходимыми помещениями, оборудованием и пр. Ответственность за функционирование системы возлагается, в первую очередь, на руководителей и уполномоченных лиц.
Основные принципы обеспечения качества, правил GMP, контроля качества и системы анализа рисков взаимосвязаны и имеют первостепенное значение в организации производства лекарственных средств.
Обеспечение качества (управление качеством)
1.1 Обеспечение качества (управление качеством) является комплексной задачей, решение которой требует реализации всех мер, направленных на достижение установленных требований к качеству лекарственных средств. Обеспечение качества основывается на выполнении требований настоящего стандарта и других нормативных документов.
Система обеспечения качества (система качества) при производстве лекарственных средств должна гарантировать следующее:
I Лекарственные средства разработаны с учетом требований настоящего стандарта (правил GMP).
II На все производственные и контрольные операции разработана документация, соответствующая требованиям настоящего стандарта.
III Ответственность и обязанности всех работников четко определены.
IV Предусмотрены меры, обеспечивающие производство, поставку и использование исходных и упаковочных материалов, соответствующих установленным требованиям.
V Контроль промежуточной продукции и технологического процесса (внутрипроизводственный контроль), аттестация (испытания) процессов и оборудования проводятся в необходимом объеме.
VI Производство и контроль готовой продукции выполняются по утвержденным инструкциям (методикам).
VII Реализация лекарственных средств до выдачи уполномоченным лицом разрешения на выпуск не допускается. Уполномоченное лицо должно подтвердить, что каждая серия продукции произведена и проверена в соответствии с требованиями, установленными при государственной регистрации лекарственного средства.
VIII Существующая система мер обеспечивает качество лекарственных средств при их хранении, отгрузке и последующем обращении в течение всего срока годности.
IX Порядок проведения самоинспекции и/или аудита качества позволяет регулярно оценивать эффективность системы обеспечения качества.
Требования к производству и контролю качества лекарственных средств (GMP)
1.2 Настоящий стандарт направлен на обеспечение качества, т.е. обеспечение гарантии того, что производство и контроль качества продукции постоянно соответствуют требованиям, установленным при государственной регистрации, нормативной документации, стандартам качества, и продукция соответствует своему назначению.
Основные требования GMP:
I Все производственные процессы должны быть четко регламентированы и должны периодически пересматриваться с учетом накопленного опыта. Следует контролировать стабильность производства лекарственных средств с заданным качеством в соответствии со спецификациями на них.
II Следует проводить аттестацию (испытания) критических стадий процессов производства, в том числе при внесении существенных изменений в технологический процесс.
III Следует обеспечить все необходимые условия для выполнения требований настоящего стандарта, в т.ч. включая наличие:
— обученного и аттестованного персонала;
— необходимых помещений и площадей;
— соответствующего оборудования и системы обслуживания;
— материалов, средств упаковки и маркировки, удовлетворяющих установленным требованиям;
— утвержденных инструкций и методик;
— требуемых условий хранения и транспортирования.
IV Инструкции и методики должны быть конкретными, изложены ясно и однозначно в письменной форме.
V Персонал должен быть обучен правильному выполнению инструкций.
VI В процессе производства следует составлять протоколы (заполняемые рукописным способом и/или с применением технических средств), документально подтверждающие фактическое проведение предусмотренных инструкциями технологических стадий и получение продукции требуемого качества в количестве, соответствующем установленным нормам. Все отклонения необходимо расследовать и протоколировать в полном объеме.
VII Протоколы на серию продукции, в т.ч. на документацию по реализации продукции, должны давать возможность прослеживать изготовление каждой серии и храниться в полном объеме в доступной форме.
VIII Порядок реализации (оптовой продажи) продукции должен сводить к минимуму любой риск для ее качества.
IX Следует организовать систему отзыва любой серии продукции из продажи или поставки.
X Рекламации на качество продукции следует тщательно рассматривать, а причины ухудшения качества расследовать с принятием соответствующих мер по их предотвращению.
1.3 Контроль качества является частью настоящего стандарта (правил GMP) и включает в себя отбор проб, проведение испытаний (анализов) и оформление соответствующей документации. Инструкции по организации, документированию и выдаче разрешения на выпуск продукции должны включать в себя проведение всех необходимых испытаний и запрещать использование исходного сырья и материалов и реализацию готовой продукции до подтверждения соответствия качества установленным требованиям.
Основные требования к контролю качества:
I Наличие необходимых помещений и оборудования, обученного персонала, утвержденных методик по отбору проб, проверке и проведению испытаний исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции, контролю окружающей среды в соответствии с требованиями настоящего стандарта (правил GMP).
II Проведение отбора проб исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции аттестованным персоналом в соответствии с методиками, утвержденными отделом контроля качества.
III Проведение испытаний аттестованными методами.
IV Составление протоколов (заполняемых рукописным способом и/или с применением технических средств), подтверждающих фактическое проведение всех необходимых отборов проб, проверок и испытаний, а также регистрацию любых отклонений и расследований в полном объеме.