кадмиевая соль что это
Химические свойства элементов: кадмий.

ИСТОРИЯ ОТКРЫТИЯ
КАДМИЙ ЭЛЕМЕНТ В ПРИРОДЕ.
ПОЛУЧЕНИЕ КАДМИЯ.
Основное сырье для получения элемента кадмия — отходы цинкового, свинцового и медного производств: пыли при обжиге цинковых концентратов, пыли свинцовоплавильных печей, медно-кадмиевые кеки цинковых электролитных заводов, остатки литопонного производства. Содержание кадмия в этих продуктах может достигать 30—40% (например, в кадмиевой фракции при ректификации цинка). Наряду с элементом кадмием цинковые и свинцовые концентраты содержат Ga, Ge, In, TI, Se и Те; содержание последних двух элементов в свинцовых концентратах достигает сотых (селена — даже десятых) долей процента.
Первые упоминания о промышленном производстве кадмия (в Верхней Силезии) относятся к 1829 г.; до 1870 г. оно не превышало 125 кг в год. В начале XX в. был разработан гидроэлектрометаллургический способ получения кадмия, и к 1925 г. его выпуск возрос с десятков до сотен тонн.Производство металлического кадмия обычно включает следующие основные стадии: выщелачивание сырья, очистку растворов от основной массы посторонних элементов, электролитическое осаждение кадмия или его цементацию на цинке, плавку выделенной губки, рафинирование и получение металла высокой чистоты.При извлечении кадмия из полу-продуктов свинцово-цинкового производства применяют амальгамные способы — цементацию амальгамой цинка и ее последующее анодное окисление, в результате чего получают продукт с содержанием 99,95%Cd.
ПРИМЕНЕНИЕ КАДМИЯ.
Соли кадмия элемента также широко применяют в стеклоделии, в фотографии, в производстве люминофоров и силиконовых каучуков, в качестве катализаторов в органическом синтезе, а так же красок различных цветов (от цвета слоновой кости до малинового). Антимониды, арсениды, селениды, сульфиды и теллуриды кадмия (для синтеза используют 99,99999%-ный Cd) обладают полупроводниковыми свойствами и применяются в фотоэлектрических и электронно-оптических приборах, — в качестве материала для фототранзисторов и фотоэлементов.
ТОКСИЧНОСТЬ КАДМИЯ И ЕГО СОЕДИНЕНИЙ.
ФИЗИЧЕСКИЕ СВОЙСТВА КАДМИЯ
СОЕДИНЕНИЯ КАДМИЯ ЭЛЕМЕНТА
Карбонат кадмия CdCО3, выделяющийся в виде белого осадка карбонатами щелочных металлов, обычно загрязнен основной солью Cd2(ОH)2CО3. Соли аммония препятствуют выделению, но при кипячении аммиак удаляется в виде газа и происходит полное осаждение. При действии NaHCО3 осаждается не основная, а средняя соль.
Нитрат кадмия Cd(NО3)2∙4H2О — расплывающиеся лучистые иглы, получаются при растворении металла или карбоната в азотной кислоте. Осторожное обезвоживание тетрагидрата при 75—80° С (или в эксикаторе над H2SО4) дает безводную соль, плавящуюся при 360° С; при более высокой температуре разлагается с выделением CdO.
Сульфид кадмия образуется при действии на растворы кадмия растворимых сульфидов или газообразного сероводорода. Цвет осадка зависит от условий выделения и меняется от зеленовато-желтого через оранжевый до красного. Желтый сульфид получается при его осаждении из холодного щелочного раствора, красный — из кислого при нагревании. Желтая форма при нагревании становится оранжево-красной, по охлаждении первоначальный желтый цвет восстанавливается; изменения цвета можно достигнуть также трением и давлением. Свежеосажденный сульфид немного растворим в разбавленных кислотах с выделением сероводорода (в соляной значительно легче, чем в серной), растворяется в концентрированном растворе хлорида аммония, но нерастворим в растворах щелочных сульфидов и очень мало — в растворе сульфида аммония. До сравнительно недавнего времени CdS, благодаря своей малой растворимости, служил основой для отделения кадмия от других элементов и использовался при его гравиметрическом, титриметрическом и колориметрическом определении.
ключевые слова: кадмий элемент. как получить кадмий элемент, кадмий элемент в природе, кадмий элемент применение. кадмий элемент свойства, кадмий элемент что это, кадмий элемент формула, кадмий элемент название..
Большая Энциклопедия Нефти и Газа
Кадмиевая соль
Ло данным Салли и Ганзена ( фирма Ferro Chemicals Corporation1), при сравнении разных солей одного и того же металла оказывается, что на стабилизирующее действие влияет присутствие гидроксильных групп и двойных связей в кислотном остатке. Так, из кадмиевых солей олеиновой, стеариновой, оксистеарииовой, рицинолевой кислот ( все они содержат 18 углеродных атомов) наилучшую стабильность при действии высокой температуры дает рицинолеат, который содержит гидр-оксильную группу и двойную связь. Эти наблюдения были учтены при разработке стабилизаторов на основе солей бария, стронция, свинца, кальция, олова. [34]
Поскольку скорость термодеструкции поливинилхлорида обратно пропорциональна его молекулярной массе, инициирование, вероятнее всего, происходит у концов цепей. Возможно, что стабилизация поливинилхлорида бариевыми и кадмиевыми солями карбо-новых кислот заключается з обмене его подвижных атомов хлора на карбоксильные группы стабилизаторов. [38]
Поскольку скорость термодеструкции поливинилхлорида обратно пропорциональна его молекулярной массе, инициирование вероятнее всего происходит у концов цепей. Возможно, что стабилизация поливинилхлорида бариевыми и кадмиевыми солями карбоновых кислот заключается в обмене его подвижных атомов хлора на карбоксильные группы стабилизаторов. [39]
Себациновую кислоту можно выделить в виде кадмиевой соли раствором ацетата кадмия или осадить ее из горячего водного раствора, прибавляя концентрированную уксусную кислоту. [40]
Себациновую кислоту из полиэфира можно выделить в виде кадмиевой соли раствором ацетата кадмия или осадить ее из горячего водного раствора, прибавляя концентрированную уксусную кислоту. [45]
Кадмий – полезные свойства, особенности и опасность металла
Этот метал не особо «раскручен». Кадмий полезен промышленности, но опасен для человека.
Что представляет собой
Кадмий – элемент таблицы Менделеева №48:
Международное, научное обозначение и формула – Cadmium (Cd).
История открытия
«Отцами» элемента в историю науки вошли немецкие аптекари и химик Фридрих Штромейер.
В 1817 году провизоры, исследуя оксид цинка, усмотрели в его составе характеристики, присущие мышьяку. Штромейер провел по их просьбе цикл реакций. Конечным продуктом оказался не мышьяк, а новый серебристый металл.
Его окрестили кадмием – по названию местной цинкосодержащей руды.
Кадм – персонаж древнегреческой мифологии, легендарный основатель и царь Фив.
Нахождение в природе
Кадмиевых месторождений на планете не найдено: редкий элемент рассеян в толще земной коры, воде, воздухе.
Тонна земной коры содержит 130 мг кадмия, литр морской воды – 0,00011 мг.
Вторая форма нахождения металла в природе – шесть собственных минералов.
Чаще кадмий сопровождает другие минералы (полсотни). Так его и добывают – попутно с другими рудами. Особенно богаты цинковые (здесь кадмий есть всегда), свинцовые, медные залежи.
Технология получения
Физико-химические характеристики
Кадмий как металл проявляет типичные характеристики: без проблем куется, тянется, полируется.
По твердости располагается между оловом и цинком. Режется ножом.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ка́дмий / Cadmium (Cd), 48 |
| Атомная масса (молярная масса) | 112,411(8) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 |
| Радиус атома | 154 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+2e) 97 пм |
| Электроотрицательность | 1,69 (шкала Полинга) |
| Электродный потенциал | −0,403 |
| Степени окисления | -2; +1; +2 |
| Энергия ионизации (первый электрон) | 867,2 (8,99) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8,65 г/см³ |
| Температура плавления | 594,1 K (321 °C) |
| Температура кипения | 1038 K (764,85 °C) |
| Уд. теплота плавления | 6,11 кДж/моль |
| Уд. теплота испарения | 59,1 кДж/моль |
| Молярная теплоёмкость | 26,0 Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,979 c=5,618 Å |
| Отношение c/a | 1,886 |
| Температура Дебая | 209 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 96,9 Вт/(м·К) |
| Номер CAS | 7440-43-9 |
При нагреве свыше 80°C легко становится порошком.
При изгибе палочки из чистого кадмия слышно потрескивание. По этому признаку его легко отличить от других металлов (кроме олова).
Химические свойства также стандартны:
По физическим, химическим свойствам сходен с цинком и ртутью. Главный недостаток кадмия – токсичность.
Где используется
Токсичность ограничивает, но не обнуляет достоинства металла. Его используют во всех сегментах, кроме пищепрома.
Промышленность
Здесь нашлось применение металлу как самостоятельной единице и компонента сплавов:
Соли металла становятся пигментами (желтый цвет). Но это приветствуется не всегда.
Coca-Cola изъяла с рынка США более 20 тысяч стаканов со своим логотипом. Причина – наличие кадмия в составе краски.
Важнейшая сфера применения – атомный комплекс:
В лабораториях металл используется как реактив.
Другие отрасли
Хорошая теплопроводность в условиях запредельно низких температур сделала металл незаменимым в криотехнике.
Ювелиры добавляют кадмий к золоту, чтобы получить зеленоватые оттенки.
Полезное свойство вещества аккумулироваться раковыми клетками используется в противоопухолевой терапии.
Ежегодное глобальное производство металла исчисляется 20 тысячами тонн.
Ограничения
Согласно Техническому регламенту Евразийского экономического союза и директиве Евросоюза, в изделиях сегмента электротехники и радиоэлектроники должно быть не более 0,01 % массовой доли кадмия.
Биологическое воздействие
Микродозы кадмия есть в биологических организмах: вещество содействует метаболизму.
Токсичность
Однако металл, его растворимые соединения токсичны:
По действию на организм напоминает ртуть, цинк, но токсичность вдвое-втрое превышает цинковую.
Кадмий классифицирован как вещество 2-го класса опасности. 7,50 г металла в кубометре воздуха убивают за двадцать секунд.
Нормы
Наличие металла в воде, продуктах питания регулируется санитарными стандартами РФ (мкг/кг):
Литр питьевой воды не может содержать более 0,001 мг кадмия.
Опасность отравления
Кадмиевая интоксикация актуальна для жителей мегаполисов и работников металлургических предприятий.
Отравление требует неотложной медицинской помощи.
Профессиональное заболевание работников металлургических предприятий – хроническое отравление. Опознается по резкому истощению, ожирению печени, сердечной мышцы, воспалению почек.
При работе обязательно использование защитных средств.
КАДМИЙ
КАДМИЙ (Cadmium) Cd, – химический элемент II группы Периодической системы. Атомный номер 48, относительная атомная масса 112,41. Природный кадмий состоит из восьми стабильных изотопов: 106 Cd (1,22%), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,26%), 114 Cd (28,85%) и 116 Cd (7,58%). Степень окисления +2, редко +1.
Кадмий был открыт в 1817 немецким химиком Фридрихом Штромейером (Stromeyer Friedrich) (1776–1835).
При проверке оксида цинка, вырабатываемого одной из шенебекских фабрик, появилось подозрение, что он содержит примесь мышьяка. При растворении препарата в кислоте и пропускании через раствор сероводорода выпадал желтый осадок, похожий на сульфиды мышьяка, однако более тщательная проверка показала, что этого элемента нет. Для окончательного заключения образец подозрительного оксида цинка и другие цинковые препараты (в том числе карбонат цинка) с этой же фабрики послали Фридриху Штромейеру, занимавшему с 1802 кафедру химии в Геттингенском университете и должность генерального инспектора ганноверских аптек.
Распространенность кадмия в природе и его промышленное извлечение.
Содержание кадмия в земной коре составляет 1,6·10 –5 %. Он близок по распространенности к сурьме (2·10 –5 %) и в два раза более распространен, чем ртуть (8·10 –6 %). Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими химическими элементами, склонными к образованию природных сульфидов. Он концентрируется в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богаты кадмием глины – до 0,3 мг/кг, в меньшей степени – известняки и песчаники (около 0,03 мг/кг). Среднее содержание кадмия в почве – 0,06 мг/кг.
У кадмия есть собственные минералы – гринокит CdS, отавит CdCO3, монтепонит CdO. Однако своих месторождений они не образуют. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0,01–5%. Кадмий накапливается также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), станните (до 0,2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т.
Характеристика простого вещества и промышленное получение металлического кадмия.
В сухом воздухе кадмий устойчив. Во влажном воздухе он быстро тускнеет, а при нагревании легко взаимодействует с кислородом, серой, фосфором и галогенами. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует.
Пары кадмия взаимодействуют с парами воды с выделением водорода. Кислоты растворяют кадмий с образованием солей этого металла. Кадмий восстанавливает нитрат аммония в концентрированных растворах до нитрита аммония. Он окисляется в водном растворе катионами некоторых металлов, например меди(II) и железа(III). С растворами щелочей, в отличие от цинка, кадмий не взаимодействует.
Основные источники кадмия – промежуточные продукты цинкового производства. Осадки металлов, полученные после очистки растворов сульфата цинка действием цинковой пыли, содержат 2–12% кадмия. Во фракциях, образующихся при дистилляционном получении цинка, содержится 0,7–1,1% кадмия, а во фракциях, полученных при ректификационной очистке цинка – до 40% кадмия. Кадмий извлекают и из пыли свинцовых и медеплавильных заводов (она может содержать до 5% и 0,5% кадмия, соответственно). Пыль обычно обрабатывают концентрированной серной кислотой, а затем сульфат кадмия выщелачивают водой.
Из растворов сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, затем ее растворяют в серной кислоте и очищают раствор от примесей действием оксида цинка или карбоната натрия, а также методами ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах либо восстановлением цинком.
Для удаления цинка и свинца металлический кадмий переплавляют под слоем щелочи. Расплав обрабатывают алюминием, чтобы удалить никель, и хлоридом аммония, чтобы избавиться от таллия. Применяя дополнительные методы очистки, можно получить кадмий с содержанием примесей 10 –5 % по массе.
В год производится около 20 тыс. т кадмия. Объем его производства в большой степени связан с масштабами производства цинка.
Важнейшей областью применения кадмия является производство химических источников тока. Кадмиевые электроды используются в батареях и аккумуляторах. Отрицательные пластины никель-кадмиевых аккумуляторов изготовлены из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты гидроксидом никеля. Электролитом служит раствор гидроксида калия. На основе кадмия и никеля изготавливают и компактные аккумуляторы для управляемых ракет, только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Процессы, протекающие в никель-кадмиевом щелочном аккумуляторе, можно описать суммарным уравнением:
Cd + 2NiO(OH) + 2H2O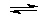
Никель-кадмиевые щелочные аккумуляторы более надежны, чем свинцовые (кислотные). Эти источники тока отличаются высокими электрическими характеристиками, стабильностью работы, длительным сроком эксплуатации. Их можно зарядить всего за один час. Однако никель-кадмиевые аккумуляторы нельзя подзаряжать без полной предварительной разрядки (в этом отношении они уступают металлогидридным аккумуляторам).
Кадмий широко используется для нанесения антикоррозионных покрытий на металлы, особенно в случаях их контакта с морской водой. Кадмируются наиболее важные детали кораблей, самолетов, а также различные изделия, предназначенные для работы в условиях тропического климата. Раньше железо и другие металлы кадмировали погружением изделий в расплавленный кадмий, сейчас кадмиевое покрытие наносят электролитически.
У кадмиевых покрытий есть некоторые преимущества по сравнению с цинковыми: они более устойчивы к коррозии, их легче сделать ровными и гладкими. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде.
Однако у кадмирования есть свои проблемы. При электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород. Он вызывает у высокопрочных сталей так называемую водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Для предотвращения этого явления в кадмиевые покрытия вводят добавку титана.
Кроме того, кадмий токсичен. Поэтому, хотя кадмированную жесть применяют довольно широко, для изготовления кухонной утвари и тары для пищевых продуктов использовать ее запрещено.
Примерно десятая часть мирового производства кадмия расходуется на производство сплавов. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкими провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но заметно превосходит ее прочностью и твердостью.
Кадмий входит в легкоплавкого сплава Вуда (Wood’s metal), содержащего 50% висмута, 25% свинца, 12,5% олова, 12,5 % кадмия. Сплав Вуда можно расплавить в кипящей воде. Любопытно, что первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК. Он был изобретен в 1860 не очень известным английским инженером Б.Вудом (B.Wood). Часто это изобретение ошибочно приписывают его однофамильцу – знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет. Легкоплавкие сплавы кадмия используют как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Резкий скачок спроса на кадмий начался в 1940-е и был связан с применением кадмия в атомной промышленности – выяснилось, что он поглощает нейтроны и из него стали делать регулирующие и аварийные стержни атомных реакторов. Способность кадмия поглощать нейтроны строго определенных энергий используется при исследовании энергетических спектров нейтронных пучков.
Соединения кадмия.
Кадмий образует бинарные соединения, соли и многочисленные комплексные, в том числе металлоорганические, соединения. В растворах молекулы многих солей, в частности галогенидов, ассоциированы. Растворы имеют слабокислотную среду вследствие гидролиза. При действии растворов щелочей, начиная с рН 7–8, осаждаются основные соли.
Оксид кадмия CdO получают при взаимодействии простых веществ или прокаливанием гидроксида либо карбоната кадмия. В зависимости от «термической истории» он может быть зеленовато-желтым, коричневым, красным или почти черным. Это частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки. Выше 900° С оксид кадмия летуч, а при 1570° С полностью возгоняется. Он обладает полупроводниковыми свойствами.
Оксид кадмия легко растворяется кислотах и плохо – в щелочах, легко восстанавливается водородом (при 900° С), монооксидом углерода (выше 350° С), углеродом (выше 500° С).
Оксид кадмия используют в качестве материала электродов. Он входит в состав смазочных масел и шихты для получения специальных стекол. Оксид кадмия катализирует ряд реакций гидрогенизации и дегидрогенизации.
Гидроксид кадмия Cd(OH)2 выпадает в виде белого осадка из водных растворов солей кадмия(II) при добавлении щелочи. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Кроме того, гидроксид кадмия переходит в раствор под действием цианидов щелочных элементов. Выше 170° С он разлагается до оксида кадмия. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Применяют гидроксид кадмия для получения других соединений кадмия, а также как аналитический реагент. Он входит в состав кадмиевых электродов в источниках тока. Кроме того, гидроксид кадмия используется в декоративных стеклах и эмалях.
Фторид кадмия CdF2 мало растворим в воде (4,06% по массе при 20° С), не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия.
Фторид кадмия используется в качестве оптического материала. Он входит в состав некоторых стекол и люминофоров, а также твердых электролитов в химических источниках тока.
Хлорид кадмия CdCl2 хорошо растворим в воде (53,2% по массе при 20° С). Его ковалентный характер обусловливает сравнительно низкую температуру плавления (568,5° С), а также растворимость в этаноле (1,5% при 25° С).
Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500° С.
Хлорид кадмия является компонентом электролитов в кадмиевых гальванических элементах и сорбентов в газовой хроматографии. Он входит в состав некоторых растворов в фотографии, катализаторов в органическом синтезе, флюсов для выращивания полупроводниковых кристаллов. Его используют как протраву при крашении и печатании тканей. Из хлорида кадмия получают кадмиеорганические соединения.
Бромид кадмия CdBr2 образует чешуйчатые кристаллы с перламутровым блеском. Он очень гигроскопичен, хорошо растворим в воде (52,9% по массе при 25° С), метаноле (13,9% по массе при 20° С), этаноле (23,3% по массе при 20° С).
Получают бромид кадмия бромированием металла или действием бромоводорода на карбонат кадмия.
Бромид кадмия служит катализатором в органическом синтезе, является стабилизатором фотоэмульсий и компонентом вирирующих составов в фотографии.
Иодид кадмия CdI2 образует блестящие кристаллы в виде листочков, у них слоистая (двумерная) кристаллическая структура. Известно до 200 политипов иодида кадмия, различающихся последовательностью расположения слоев с гексагональной и кубической плотнейшей упаковкой.
В отличие от других галогенов, иодид кадмия не гигроскопичен. Он хорошо растворяется в воде (46,4% по массе при 25° С). Получают иодид кадмия иодированием металла при нагревании или в присутствии воды, а также действием иодоводорода на карбонат или оксид кадмия.
Иодид кадмия служит катализатором в органическом синтезе. Он является компонентом пиротехнических составов и смазочных материалов.
Сульфид кадмия CdS был, вероятно, первым соединением этого элемента, которым заинтересовалась промышленность. Он образует кристаллы от лимонно-желтого до оранжево-красного цвета. Сульфид кадмия обладает полупроводниковыми свойствами.
В воде это соединение практически не растворяется. К действию растворов щелочей и большинства кислот он также устойчив.
Получают сульфид кадмия взаимодействием паров кадмия и серы, осаждением из растворов под действием сероводорода или сульфида натрия, реакциями между кадмий- и сераорганическими соединениями.
Сульфид кадмия – важный минеральный краситель, раньше его называли кадмиевой желтью.
В малярном деле кадмиевая желть впоследствии стала применяться шире. В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия использовали также в текстильном и мыловаренном производствах. Соответствующие коллоидные дисперсии применяли для получения цветных прозрачных стекол.
В последние годы чистый сульфид кадмия вытесняется более дешевыми пигментами – кадмопоном и цинкокадмиевым литопоном. Кадмопон – смесь сульфида кадмия и сульфата бария. Его получают, смешивая две растворимые соли – сульфат кадмия и сульфид бария. В результате образуется осадок, содержащий две нерастворимые соли:
CdSO4 + BaS = CdS Ї + BaSO4 Ї
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Литопон – кремового цвета или цвета слоновой кости.
С добавками селенида кадмия, сульфида цинка, сульфида ртути и других соединений сульфид кадмия дает термически устойчивые пигменты с яркой окраской от бледно-желтой до темно-красной.
Сульфид кадмия придает пламени синюю окраску. Это его свойство используют в пиротехнике.
Кроме того, сульфид кадмия применяется как активная среда в полупроводниковых лазерах. Он случит в качестве материала для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофоров.
Селенид кадмия CdSe образует темно-красные кристаллы. Он не растворяется в воде, разлагается соляной, азотной и серной кислотами. Получают селенид кадмия сплавлением простых веществ или из газообразных кадмия и селена, а также осаждением из раствора сульфата кадмия под действием селеноводорода, реакцией сульфида кадмия с селенистой кислотой, взаимодействием между кадмий- и селенорганическими соединениями.
Селенид кадмия является люминофором. Он служит в качестве активной среды в полупроводниковых лазерах, является материалом для изготовления фоторезисторов, фотодиодов, солнечных батарей.
Селенид кадмия является пигментом для эмалей, глазурей и художественных красок. Селенидом кадмия окрашивают рубиновое стекло. Именно он, а не оксид хрома, как в самом рубине, сделал рубиново-красными звезды московского Кремля.
Теллурид кадмия CdTe может иметь окраску от темно-серой до темно-коричневой. Он не растворяется в воде, но разлагается концентрированными кислотами. Его получают взаимодействием жидких или газообразных кадмия и теллура.
При нарушении стехиометрии или введении примесей (например, атомов меди и хлора), теллурид кадмия приобретает светочувствительные свойства. Это используется в электрофотографии.
Кадмиеорганические соединения CdR2 и CdRX (R = CH3, C2H5, C6H5 и другие углеводородные радикалы, Х – галогены, OR, SR и др.) обычно получают из соответствующих реактивов Гриньяра. Они термически менее устойчивы, чем их цинковые аналоги, однако в целом менее реакционноспособны (обычно не воспламеняются на воздухе). Их наиболее важной областью применения является получение кетонов из хлорангидридов кислот.
Биологическая роль кадмия.
Кадмий обнаруживается в организмах практически всех животных (у наземных около 0,5 мг на 1 кг массы, а у морских – от 0,15 до 3 мг/кг). Вместе с тем его относят к наиболее токсичным тяжелым металлам.
Кадмий сосредотачивается в организме преимущественно в почках и печени, при этом содержание кадмия в организме к старости повышается. Он накапливается в виде комплексов с белками, которые участвуют в ферментативных процессах. Попадая в организм извне, кадмий оказывает ингибирующее действие на целый ряд ферментов, разрушая их. Его действие основано на связывании группы –SH цистеиновых остатков в белках и ингибировании SH-ферментов. Он может также ингибировать действие цинксодержащих ферментов, замещая цинк. Из-за близости ионных радиусов кальция и кадмия, он может замещать кальций в костной ткани.
Классическим примером хронического отравления кадмием является заболевание, впервые описанное в Японии в 1950-е и получившее название «итай-итай». Болезнь сопровождалась сильными болями в поясничной области, болью в мышцах. Появлялись и характерные признаки необратимого поражения почек. Были зафиксированы сотни смертельных исходов «итай-итай». Заболевание приняло массовый характер в силу высокой загрязненности окружающей среды в Японии в то время и специфики питания японцев – преимущественно рисом и морепродуктами (они способны накапливать кадмий в высоких концентрациях). Исследования показали, что заболевшие «итай-итай» потребляли до 600 мкг кадмия в сутки. В дальнейшем в результате мероприятий по охране окружающей среды, частота и острота синдромов, подобных «итай-итай» заметно снизилась.
В США была обнаружена зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний.
Считают, что без вреда для здоровья в организм человека в сутки может поступать около 1 мкг кадмия на 1 кг собственного веса. В питьевой воде кадмия не должно содержаться более 0,01 мг/л. Противоядием при отравлении кадмием является селен, однако употребление продуктов, богатых этим элементом, приводит к понижению содержания серы в организме, и в этом случае кадмий снова становится опасным.



