Существуют такие типы мышечного сокращения
Виды мышечных сокращений
Содержание
Механика мышечных сокращений [ править | править код ]
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Суперпозиция и тетанус [ править | править код ]
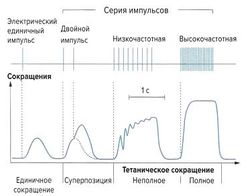
Однократное электрическое раздражение (рис. 1, вверху) ведет к единичному мышечному сокращению (рис. 1, внизу). Два близко друг за другом следующих раздражения накладываются друг на друга (это называется «суперпозиция», или суммация сокращений), что ведет к более сильному мышечному ответу, близкому к максимальному. Серия часто повторяющихся электрических раздражений вызывает возрастающие по силе мышечные сокращения, в результате чего не происходит должного расслабления мышцы. Если частота электрических импульсов выше частоты слияния, то единичные раздражения сливаются в одно и вызывают тетанус мышцы (тетаническое сокращение) — устойчивое достаточно длительное напряжение сокращенной мышцы.
Формы сокращений [ править | править код ]
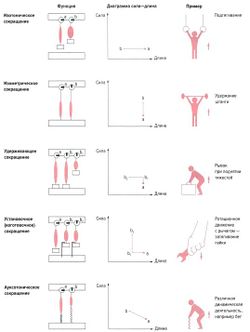
Выделяют различные функциональные формы мышечных сокращений (рис. 2).
Использованные здесь термины нетипичны для русской литературы по мышечной активности. В отечественной литературе принято выделять следующие типы сокращений.
Виды мышечных сокращений
Содержание
Механика мышечных сокращений [ править | править код ]
Если мышцу стимулировать коротким электрическим импульсом, спустя небольшой латентный период происходит ее сокращение. Такое сокращение называется «одиночное сокращение мышцы». Одиночное мышечное сокращение длится около 10-50 мс, причем оно достигает максимальной силы через 5-30 мс.
Каждое отдельное мышечное волокно подчиняется закону «все или ничего», т. е. при силе раздражения выше порогового уровня происходит полное сокращение с максимальной для данного волокна силой, а ступенчатое повышение силы сокращения по мере увеличения силы раздражения невозможно. Поскольку смешанная мышца состоит из множества волокон с различным уровнем чувствительности к возбуждению, сокращение всей мышцы может быть ступенчатым в зависимости от силы раздражения, при этом при сильных раздражениях происходит активация глубжележащих мышечных волокон.
Суперпозиция и тетанус [ править | править код ]
Однократное электрическое раздражение (рис. 1, вверху) ведет к единичному мышечному сокращению (рис. 1, внизу). Два близко друг за другом следующих раздражения накладываются друг на друга (это называется «суперпозиция», или суммация сокращений), что ведет к более сильному мышечному ответу, близкому к максимальному. Серия часто повторяющихся электрических раздражений вызывает возрастающие по силе мышечные сокращения, в результате чего не происходит должного расслабления мышцы. Если частота электрических импульсов выше частоты слияния, то единичные раздражения сливаются в одно и вызывают тетанус мышцы (тетаническое сокращение) — устойчивое достаточно длительное напряжение сокращенной мышцы.
Формы сокращений [ править | править код ]
Выделяют различные функциональные формы мышечных сокращений (рис. 2).
Использованные здесь термины нетипичны для русской литературы по мышечной активности. В отечественной литературе принято выделять следующие типы сокращений.
Существуют такие типы мышечного сокращения
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
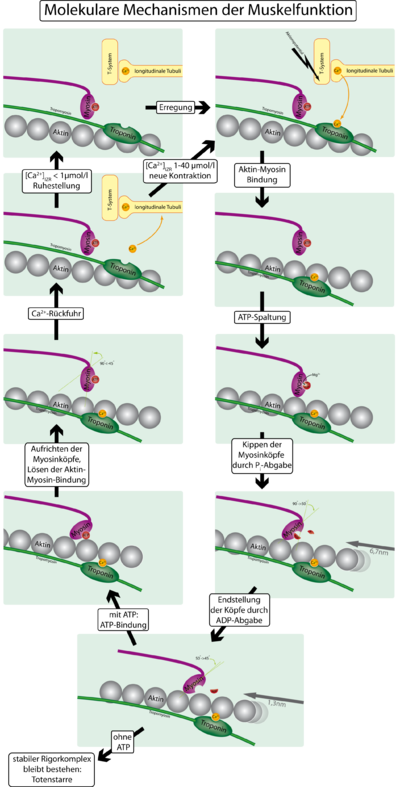
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
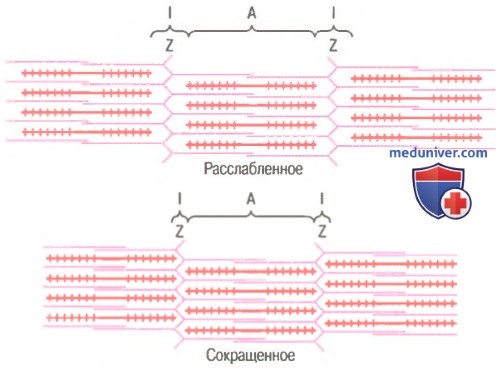
Молекулярные механизмы мышечного сокращения
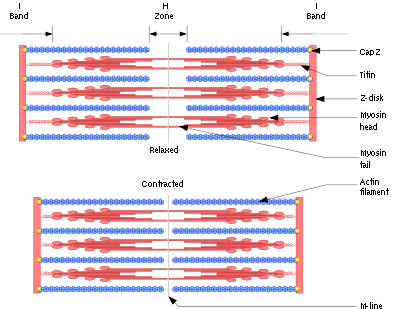
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
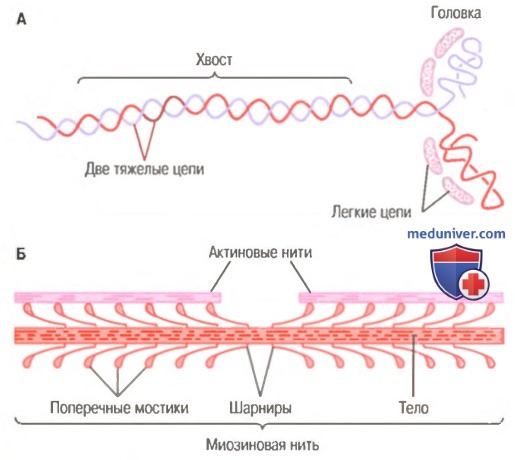
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
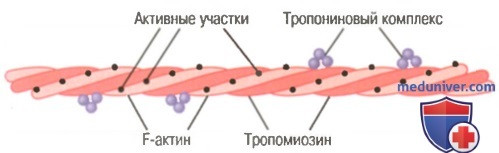
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Существуют такие типы мышечного сокращения
Гладкие мышцы содержат актиновые и миозиновые нити, имеющие химические характеристики, подобные актиновым и миозиновым нитям скелетных мышц. Но в гладких мышцах нет тропонинового комплекса, необходимого для запуска сокращения скелетной мышцы, следовательно, механизм инициации сокращения в них другой. Этот механизм подробно обсуждается далее в нашей статье.
Химические исследования показали, что актиновые и миозиновые нити, извлеченные из гладких мышц, взаимодействуют друг с другом во многом так же, как и в скелетной мышце. Более того, процесс сокращения активируется ионами кальция, а энергия для сокращения обеспечивается разрушением АТФ до АДФ.
Существуют, однако, значительные различия в морфологической организации гладких и скелетных мышц, а также в сопряжении возбуждения и сокращения, механизме запуска ионами кальция сократительного процесса, длительности сокращения и количестве энергии, необходимой для сокращения.
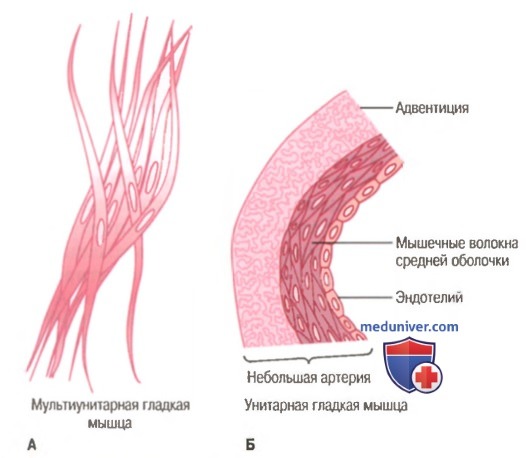
Морфологическая основа сокращения гладких мышц
Гладкие мышцы не имеют такой упорядоченной организации актиновых и миозиновых нитей, которая обнаруживается в скелетных мышцах, придавая им «полосатость». С помощью техники электронной микрофотографии выявляется гистологическая организация. Видно большое число актиновых нитей, прикрепленных к так называемым плотным тельцам. Некоторые из этих телец прикрепляются к клеточной мембране, другие распределяются внутри клетки. Некоторые из мембранных плотных телец соседних клеток связываются вместе мостиками из внутриклеточных белков. Через эти мостики в основном передается сила сокращения от одной клетки к другой.
В мышечном волокне среди актиновых нитей разбросаны миозиновые нити. Их диаметр более чем в 2 раза превышает диаметр актиновых нитей. На электронных микрофотографиях актиновых нитей обычно обнаруживают в 5-10 раз больше, чем миозиновых.
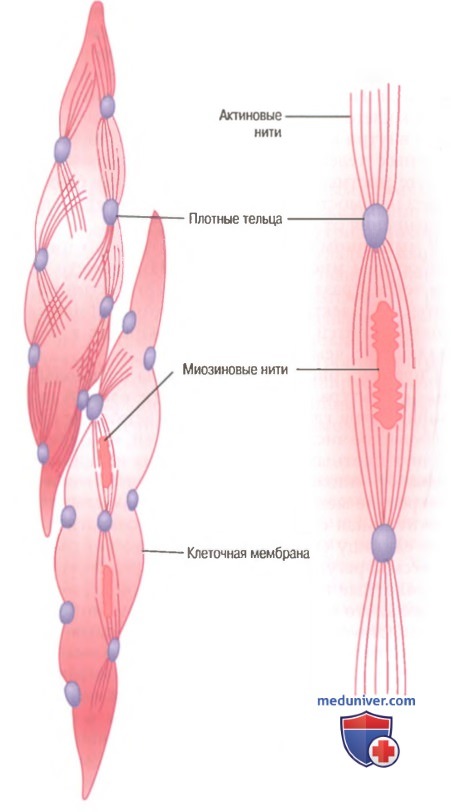
На рисунке представлена предполагаемая структура отдельной сократительной единицы внутри гладкомышечной клетки, где видно большое число актиновых нитей, исходящих от двух плотных телец; концы этих нитей перекрывают миозиновую нить, расположенную посередине между плотными тельцами. Эта сократительная единица похожа на сократительную единицу скелетной мышцы, но без специфической регулярности ее структуры. В сущности, плотные тельца гладкой мышцы играют ту же роль, что и Z-диски в скелетной мышце.
Существует и другое различие. Большинство миозиновых нитей имеют поперечные мостики с так называемой боковой полярностью. Мостики организованы следующим образом: на одной стороне они шарнирно фиксируются в одном направлении, а на другой — в противоположном направлении. Это позволяет миозину тянуть актиновую нить с одной стороны в одном направлении, одновременно продвигая с другой стороны другую актиновую нить в противоположном направлении. Такая организация позволяет гладкомышечным клеткам сокращаться с укорочением до 80% их длины вместо укорочения менее чем на 30%, характерного для скелетной мышцы.
Большинство скелетных мышц сокращаются и расслабляются быстро, но сокращения гладких мышц в основном являются длительными тоническими сокращениями, которые иногда продолжаются в течение нескольких часов или даже дней. Следовательно, можно ожидать, что морфологические и химические особенности гладких мышц должны отличаться от соответствующих характеристик скелетных мышц. Далее обсуждаются некоторые из этих отличий.
Медленная циклическая активность миозиновых поперечных мостиков. В гладкой мышце по сравнению соскелетной гораздо меньше скорость циклической активности миозиновых поперечных мостиков, т.е. скорость их прикрепления к актину, отсоединение от актина и повторное прикрепление для осуществления следующего цикла. Фактически частота циклов составляет лишь от 1/10 до 1/300 этого показателя в скелетной мышце. Однако, как считают, в гладкой мышце значительно больше относительное количество времени, в течение которого поперечные мостики остаются прикрепленными к актиновым нитям, что является главным фактором, определяющим силу сокращения. Возможной причиной медленного циклирования является гораздо меньшая по сравнению со скелетной мышцей АТФ-азная активность головок поперечных мостиков, в связи с чем скорость разрушения АТФ — источника энергии для движения головок поперечных мостиков — значительно снижена с соответствующим замедлением скорости их циклов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мышечное сокращение
Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора, реже гормона, проявляющаяся в уменьшении длины клетки. Эта жизненно важная функция организма, связанная с оборонительными, дыхательными, пищевыми, половыми, выделительными и другими физиологическими процессами.
Все виды произвольных движений — ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счёт скелетных мышц. Непроизвольные движения (кроме сокращения сердца) — перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря — обусловлены сокращением гладкой мускулатуры. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Содержание
Введение
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1 — 2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca 2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50 %.
Скольжение миозина относительно актина
Головки миозина расщепляют АТФ и за счет высвобождающейся энергии меняют конформацию, скользя по актиновым филаментам. Цикл можно разделить на 4 стадии:
Далее цикл повторяется до уменьшения концентрации ионов Ca 2+ или исчерпании запаса АТФ (в результате смерти клетки). Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актин-зависимая АТФаза. Так как каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
Источник энергии для сокращения
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин. Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется. Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Механизм регуляции
В основном в регуляции мышечной активности участвуют нейроны, но есть случаи, когда сокращением гладкой мускулатуры управляют и гормоны (например, адреналин и окситоцин). Сигнал о сокращении можно разделить на несколько этапов:
От клеточной мембраны до саркоплазматического ретикулума
От выделения ионов Ca 2+ до сокращения миофибрилл
Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T,I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca 2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.