Супрессивные препараты что такое
ВЫБОР АНТИМИКРОБНЫХ ХИМИОПРЕПАРАТОВ ПРИ ВИРУСНЫХ ИНФЕКЦИЯХ. ГЕРПЕТИЧЕСКИЕ ИНФЕКЦИИ.
Герпетические инфекции представляют собой группу инфекционных заболеваний, вызываемых вирусами герпеса человека. Установлено, что среди обширного семейства герпесов только 6 типов вызывают различные заболевания человека:
Вирусы герпеса, кроме varicella-zoster, передаются преимущественно при контакте жидкостей тела носителя (кровь, слюна, сперма, секрет слизистых) с чувствительными участками тела неинфицированного человека. Это осуществляется контактным (в том числе половым) и трансфузионным путями, а также при трансплантации органов.
Вирус varicella-zoster передается воздушно-капельным путем. В дальнейшем вирус распространяется внутри организма гематогенным, лимфогенным и нейрогенным путями, инфицирует сенсорные ганглии вегетативной нервной системы, что практически обеспечивает его пожизненную персистенцию в организме человека. Это обстоятельство во многом определяет хроническое рецидивирующее течение инфекции, влияет на характер назначаемого лечения и его результаты.
Попытки одновременного применения иммуномодуляторов, индукторов интерферона, гормонов тимуса, адаптогенов и т.п. с целью активизации факторов иммунной защиты и повышения эффективности лечения лишены серьезных оснований. Нет ни одного исследования, выполненного в рамках доказательной медицины, свидетельствующего о положительном влиянии подобного рода «сопутствующей» терапии.
Несмотря на многочисленные и длительные исследования, до сих пор не получено эффективной профилактической вакцины против герпесвирусов, за исключением вируса varicella-zoster. Локальный характер поражения и латентное течение инфекции без вирусемии приводят к тому, что даже успешная выработка антител не предотвращает очередного рецидива.
Местное лечение очагов поражения наружными формами специфических препаратов возможно лишь при herpes labialis и, в сочетании с системным введением, при герпетическом кератите. При его осуществлении в продромальном периоде или сразу после первичных проявлений длительность обострения уменьшается и выраженность симптомов смягчается. В дополнение к специфическим препаратам целесообразно местное применение антисептиков при вторичной бактериальной инфекции, что способствует более быстрой эпителизации эрозивно-язвенных поражений.
ОРОФАЦИАЛЬНЫЙ ГЕРПЕС
Орофациальный герпес чаще вызывается ВПГ-1. Первичный эпизод обычно протекает в виде гингивостоматита и фарингита, рецидивы, как правило, в виде herpes labialis.
Выбор антимикробных препаратов
Лечение первичного эпизода проводится одним из противогерпетических ЛС для приема внутрь:
Лечение первичного эпизода можно продолжать до 10 и более дней, если не произошло заживление элементов.
При ограниченных очагах и редких рецидивах herpes labialis можно ограничиться только местным лечением, которое проводится 5% кремом ацикловира или 2% кремом пенцикловира. Эффективность терапии зависит от сроков ее начала. Терапию следует начинать при появлении первых признаков наступающего рецидива в виде легкого зуда, парестезий, покраснения или в течение первых суток после появления пузырьковых высыпаний. Крем наносят на очаги поражения 5-6 раз в сутки в течение 5-10 дней. При наличии вторичной бактериальной инфекции элементы обрабатываются антисептиками. Местное лечение можно сочетать с системным, в случаях обширных поражений и частых рецидивов. При этом используется один из нижеприведенных режимов терапии внутрь, которые обладают равной эффективностью:
ГЕНИТАЛЬНЫЙ ГЕРПЕС
Генитальный герпес вызывается обоими серотипами: ВПГ-1 (до 10%) и ВПГ-2 (90% случаев). Около 30% первичных эпизодов заболевания ассоциированы с ВПГ-1, однако число рецидивов значительно больше в случаях инфицирования ВПГ-2. Поэтому идентификация типов ВПГ имеет определенное значение для прогнозирования течения заболевания.
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
Специфическое лечение необходимо начинать как можно раньше после появления первых симптомов заболевания. Системная противовирусная химиотерапия позволяет добиться исчезновения клинических проявлений первичного эпизода или рецидива инфекции, а также предупредить их появление при условии начала лечения в продромальном периоде или в течение 1 сут после появления клинических признаков герпеса. Однако она не приводит к эрадикации вируса и не всегда влияет на частоту, тяжесть и риск развития рецидивов в последующем.
Существуют следующие подходы к системной противовирусной терапии генитального герпеса:
ПЕРВИЧНЫЙ ЭПИЗОД ГЕНИТАЛЬНОГО ГЕРПЕСА
Выбор антимикробных препаратов
Препараты выбора: ацикловир внутрь 0,2 г x 5 раз в сутки; ацикловир внутрь 0,4 г каждые 8 ч; ацикловир внутрь 0,8 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,25 г каждые 8 ч.
Длительность терапии: 5 дней
Лечение первичного эпизода можно продолжать до 10 и более дней, если не произошло заживление элементов.
При первичном эпизоде герпетического проктита суточная доза ацикловира должна быть увеличена (внутрь 0,4 г x 5 раз в сутки в течение 7-10 дней).
РЕЦИДИВИРУЮЩИЙ ГЕНИТАЛЬНЫЙ ГЕРПЕС
Выбор антимикробных препаратов
Препараты выбора: ацикловир внутрь 0,2 г х 5 раз в сутки; ацикловир внутрь 0,4 г каждые 8 ч; ацикловир внутрь 0,8 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,125 г каждые 12 ч.
Профилактическая (превентивная или супрессивная) терапия
Препараты выбора: ацикловир внутрь 0,4 г каждые 12 ч; валацикловир внутрь 0,5 г каждые 24 ч; фамцикловир внутрь 0,25 г каждые 12 ч.
Профилактическая (превентивная или супрессивная) терапия показана при частоте обострений 6 и более эпизодов в год. Число рецидивов при этом уменьшается на 75% и более, облегчается их клиническое течение и улучшается психосексуальное самочувствие больных.
При рецидивировании чаще 10 раз в год возможно применение супрессивной терапии валацикловиром в дозе 0,25 г или 0,5 г каждые 12 ч. Существующий опыт применения супрессивной терапии показал ее эффективность и безопасность. Длительность курса составляет от 3-6 мес до 1 года и более.
После 1 года такого лечения необходимо по желанию пациента делать перерывы для оценки естественного течения заболевания. При этом достаточно наблюдение в течение как минимум 2 обострений.
Так как заражение возможно при отсутствии симптомов заболевания, то пациентам рекомендуется использовать барьерные методы контрацепции (мужские и женские презервативы) при всех половых контактах со здоровыми партнерами.
Влияние супрессивной терапии на уменьшение асимптоматического выделения вируса и, соответственно, уменьшение риска передачи вируса продолжает изучаться.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕНИТАЛЬНОГО ГЕРПЕСА У БЕРЕМЕННЫХ И НОВОРОЖДЕННЫХ
Безопасность системной терапии беременных ацикловиром, валацикловиром и фамцикловиром полностью не доказана. Назначение ацикловира беременным во время I триместра не повышает риск возникновения врожденных дефектов, по сравнению со средним уровнем в популяции. Результаты применения валацикловира и фамцикловира при беременности носят предварительный характер и не могут быть основанием для их регулярного использования.
Ацикловир может с осторожностью применяться беременными внутрь в дозах, указанных выше, как во время первичного эпизода, так и при рецидивах герпеса.
При наличии у беременной симптомов генитального герпеса накануне или у роженицы во время родов показано кесарево сечение. Однако при герпетическом поражении шейки матки и безводном промежутке более 4-6 ч оперативное родоразрешение не предупреждает заражение новорожденного.
Применение беременным с рецидивирующим генитальным герпесом супрессивной терапии ацикловиром (0,4 г каждые 12 ч) за 4 нед до предполагаемого срока родов может предотвратить обострение и, таким образом, позволить родоразрешение через естественные родовые пути.
Несмотря на все профилактические меры нельзя полностью исключить возможность заражения новорожденных, поэтому необходимо тщательное наблюдение за ними.
При наличии признаков герпеса лечение новорожденных проводится незамедлительно ацикловиром в/в 30-60 мг/кг/сут в 3 введения в течение 21 дня.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ГЕНИТАЛЬНОГО ГЕРПЕСА У ПАЦИЕНТОВ С ИММУНОДЕФИЦИТОМ И ВИЧ-ИНФИЦИРОВАННЫХ
Поражения, вызванные ВПГ у пациентов с иммунодефицитными состояниями (ВИЧ, лучевая, химиотерапия и др.), встречаются довольно часто и характеризуются тяжелым и нередко атипичным течением.
Выбор антимикробных препаратов
Эпизодическая терапия рецидивов
Препараты выбора: ацикловир внутрь 0,4 г ґ 5 раз в сутки; валацикловир внутрь 1 г каждые 12 ч; фамцикловир внутрь 0,5 г каждые 12 ч.
Длительность терапии: 5-10 дней.
Препараты выбора: ацикловир внутрь 0,4-0,8 г каждые 8-12 ч; валацикловир внутрь 0,5 г каждые 12 ч; фамцикловир внутрь 0,5 г каждые 12 ч.
При тяжелом течении эпизодов, а также при осложненной форме (диссеминированная инфекция, пневмония, гепатит, менингит, энцефалит и др.) как при отсутствии, так и при наличии иммунодефицитного состояния, необходимо в/в введение ацикловира в дозе 5 мг/кг/сут в течение 5-7 дней или до выздоровления.
При отсутствии эффекта от максимальных доз ацикловира возможно обнаружение ацикловирорезистентных штаммов ВПГ, которые также устойчивы к валацикловиру и фамцикловиру. В этих случаях рекомендуется фоскарнет (в России не зарегистрирован) в/в 0,04 мг/кг каждые 8 ч до ликвидации клинических проявлений.
Местное лечение генитального герпеса наружными формами противогерпетических препаратов неэффективно. При присоединении вторичной бактериальной инфекции, пораженные участки обрабатываются антисептиками.
ИНФЕКЦИИ, ВЫЗЫВАЕМЫЕ ВИРУСОМ varicella-zoster
Ветряная оспа представляет собой первичную инфекцию, вызываемую вирусом varicella-zoster. У детей (90% заболевания встречается до 13 лет) заболевание протекает относительно легко, у взрослых может осложниться энцефалитом и пневмонией.
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
Протигерпетические препараты используются для лечения обоих заболеваний. Они укорачивают период высыпаний на коже в среднем на один день, уменьшают число новых кожных элементов примерно на 25% и ослабляют выраженность общих симптомов у трети пациентов. Специфическое лечение необходимо начинать в первые сутки после начала заболевания. При опоясывающем лишае системная противовирусная терапия ускоряет заживление кожных элементов и уменьшает частоту острого неврита.
У детей 2-16 лет применяют ацикловир внутрь 20 мг/кг (но не более 0,8 г) каждые 6 ч в течение 5 дней.
У взрослых используют следующие режимы лечения:
Алгоритмы диагностики и лечения высокодифференцированого рака щитовидной железы
Гарбузов П.И.
Медицинский Радиологический Научный Центр РАМН, Обнинск
ЛЕЧЕНИЕ
Хирургия, ТТГ-супресивная терапия, радиойодтерапия, дистанционная лучевая терапия, химиотерапия и редифференцирующая терапия используются в настоящее время на различных этапах лечения. При этом в первую очередь при дифференцированном раке щитовидной железы проводится хирургическое удаление первичной опухоли и регионарных метастазов
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Стандартной операцией при ДРЩЖ является тотальная или околототальная тиреоидэктомия. Выполнение тотальной тиреоидэктомии на стороне опухоли и околототальной тиреоидэктомии на противоположной стороне позволяет сохранять кровоснабжение паращитовидных желез, что значительно снижает риск тяжелой послеоперационной гипокальциемии. Гемитиреоидэктомия на стороне первичной опухоли может быть адекватной только в случае обнаружения папиллярной микрокарциномы с диаметром опухоли Ј 1см, так как рак щитовидной железы довольно часто бывает многофокусным и с двухсторонним поражением.
ТТГ-СУПРЕССИВНАЯ ТЕРАПИЯ
Несмотря на то, что пока нет проспективных исследований эффективности ТТГ супрессивной терапии, но ретроспективные данные эпохи рутинной аблации йодом-131 показали значительное статистически значимое уменьшение 10 летних рецидивов с 20% у больных без медикаментозной терапии до 12% у больных, которые получали L-Т4 в дополнении к хирургии. Некоторые противоречия существуют относительно оптимального уровня ТТГ супрессии, так как супрессивная дозировка L-Т4 может вызывать такие неблагоприятные эффекты, как увеличения риска предсердной фибрибляции и деминерализации костей. При отсутствии такого риска супрессивная терапия рекомендуется ниже 0,1–0,2 МЕ/мл. Альтернативный, риск-ориентированный подход предлагает ТТГ-супрессию ниже 0,1 МЕ/мл у больных с высоким риском опухолевого роста или рецидива и ТТГ супрессия ниже нормального уровня у больных с низким уровнем
ЛУЧЕВОЕ ЛЕЧЕНИЕ
Повторное введение 131 I с интервалом 3 – 6 месяцев проводится при выявлении очагов гиперфиксации РФП до их полного исчезновения, отсутствия ультразвуковых и/или рентгенологических признаков рецидива опухоли и метастазов РЩЖ и снижении уровня ТГ в сыворотки крови
Иммуносупрессивные препараты
Содержание
Ингибирование иммунных реакций [ править | править код ]
Ингибирование иммунных реакций целесообразно при пересадке органов для предотвращения отторжения трансплантата и при аутоиммунных заболеваниях. Иммуносупрессия в свою очередь подразумевает ослабление защиты от инфекций, а также риск возникновения злокачественных новообразований.
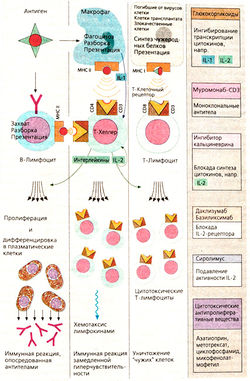
Специфическая иммунная реакция начинается с присоединения антигена к лимфоциту. В-Лимфоциты «узнают» поверхностную структуру с помощью мембранных рецепторов, которые похожи на образующиеся затем антитела. Т-Лимфоциты узнают антигены, представленные на поверхности макрофагов, с помощью молекул главного комплекса гистосовместимости (МНС, от англ, major histocompatibility complex). T-Клетки имеют на поверхности молекулы CD3 и CD4 (Т-хелперы) или CD8 (цитотоксические Т-лимфоциты), которые взаимодействуют с МНС. Помимо узнавания антигена для активации лимфоцита необходима стимуляция с помощью медиаторов типа цитокинов. Интерлейкин 1 образуется макрофагами, другие интерлейкины, в том числе интелейкин 2, — Т-хелперами. Антигенспецифичные лимфоциты пролиферируют, и возникает иммунный ответ.
I. Воздействие на механизм узнавания антигена. Муромонаб-СРЗ является мышиным моноклональным антителом против CD3, который участвует в узнавании антигена и взаимодействует с Т-лимфоцитами (применяют при реакции отторжения трансплантата) при лечении рассеянного склероза. Этому заболеванию приписывают аутоагрессию, обусловленную действием Т-лимфоцитов против олигодендроцитов, которые образуют миелиновую оболочку нейронов в ЦНр. Миелиновый белок действует, очевидно, как антиген. Ему подобен глатирамер; он ингибирует антигенные рецепторы, что усиливает узнавание антигена лимфоцитами.
II. Ингибирование образования цитокинов и их активности. Глюкокортикоиды модулируют экспрессию множества генов. Так, например, они блокируют образование интерлейкинов 1 и 2, что в свою очередь тормозит иммунный ответ Т-хелперов. Глюкокортикоиды взаимодействуют с другими цитокинами и медиаторами воспаления. Их назначают при реакции отторжения трансплантата, аутоиммунных заболеваниях и аллергических реакциях. Системное применение опасно развитием синдрома Кушинга.
Анакинра — генно-инженерный препарат, антагонист рецепторов интерлейкина 1. Анакинра применяется при лечении ревматоидного артрита (с. 340).
Даклизумаб и базиликсимаб представляют собой моноклональные антитела против рецептора интерлейкина 2. Они состоят из мышиных РаЬ-фрагментов и человеческого Fc-фрагмента. Применяют при реакции отторжения трансплантата.
Глатирамерацетат состоит из синтетических пептидов с различной длиной цепи, составленной из аминокислот в случайной последовательности: глутаминовой кислоты, лизина, аланина и тирозина (название глатирамер возникло из первых букв аминокислот — они выделены). Этот препарат может применяться наряду с р-интерфероном
III. Нарушение метаболизма клетки ингибированием пролиферации. Некоторые цитостатики также применяются в качестве иммунодепрессантов, но в более низких дозах, чем для лечения опухолей. К ним относятся азатоприн, метотрексат и циклофосфамцц. Они оказывают неспецифическое антипролифератив-ное действие как на В-, так и на Т-клетки. Мофетилмикофенолат действует специфически на пролиферацию лимфоцитов, блокирует инозинмонофосфатдегидрогена-зу, которая необходима лимфоцитам для синтеза пуринов. Препарат применяют при острых реакциях отторжения трансплантата.
IV. Иммунная сыворотка против Т-клеток получается при иммунизации лабораторных животных человеческими Т-лим-фоцитами. Препарат повреждает Т-лим-фоциты и применяется для ослабления реакции отторжения трансплантата.
Ингибиторы кальциневрина, сиролимус [ править | править код ]
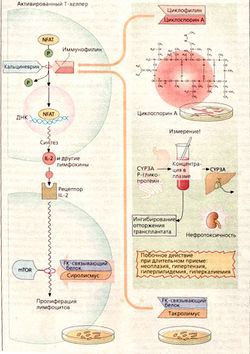
Циклоспорин А получают из грибов. Это циклический полипептид, состоящий из 11 аминокислот, в том числе атипичных. Поэтому при пероральном приеме он не разрушается протеазами желудочно-кишечного тракта. В Т-хелперах циклоспорин А ингибирует образование интерлейкина 2, участвуя в регуляции транскрипции этого белка.
В норме «ядерный фактор активации Т-клеток» (NFAT) может вызвать экспрессию интерлейкина 2. Для этого необходима стадия дефосфорилирования NFAT при катализе фосфатазой кальциневрином, что д елает возможным поступление NFAT из цитозоля в клеточное ядро. Циклоспорин А внутри клетки связывается с белком циклофилином. Этот комплекс ингибирует кальциневрин и тем самым останавливает образование интерлейкина 2.
Успехи современной трансплантационной медицины в значительной мере обязаны внедрению в практику циклоспорина А. В настоящее время его применяют и при определенных аутоиммунных заболеваниях, атопическом дерматите и других болезнях.
В качестве нежелательного эффекта можно назвать нефротоксичность препарата. Дозы должны выбираться с учетом того, чтобы концентрация в крови была не слишком высокой (возрастание риска нарушения работы почек) и не слишком низкой (риск реакции отторжения трансплантатов). К тому же терапия циклоспорином А трудно управляема. При пероральном приеме биодоступность неполная. Р-Гликопротеин в стенках кишечника транспортирует вещество обратно в просвет кишечника, или оно разрушается цитохромоксидазой типа ЗА. Ферменты печени CYP-3A метаболизируют циклоспорин и отвечают за его пресистемную элиминацию. Лекарства, действующие на CYP-3A и Р-гликопротеины, могут взаимодействовать между собой. Для оптимального назначения лекарства необходимо провести полный анализ крови пациента.
Медикаментозное ингибирование отторжения трансплантатов должно проводиться продолжительное время. Повышенный риск развития злокачественных опухолей является ответом на подавление иммунной системы организма. Для долгосрочных прогнозов существенно то, что повышается риск возникновения сердечно-сосудистых заболеваний.
Такролимус — макролидный антибиотик; вырабатывается стрептомицетами. Действует аналогично циклоспорину А. На молекулярном уровне также может рассматриваться как рецептор, но не циклофилина, а так называемого FK-связывающего белка. Такролимус используется для предотвращения отторжения трансплантатов. Лучше проникает через эпителий, чем циклоспорин А, и может применяться локально при атопическом дерматите.
Иммуносупрессивные препараты [ править | править код ]
Иммуносупрессивные препараты — это лекарственные препараты разных фармакологических химических групп, которые подавляют реакции иммунитета через опосредованное угнетение функции клеток иммунокомпетентной системы. Такие средства применяют для лечения тяжелых гипериммунных заболеваний и угнетения реакции отторжения трансплантата, а также для ослабления воспалительных процессов неопределенной этиологии.
Известные сегодня иммуносупрессивные препараты характеризуются разной активностью: мягкое иммуносупрессивное действие оказывают НПВС, гепарин, препараты золота, пенициллин, производные 4-аминохинолина и др., в связи с чем их называют «малыми» иммуносупрессантами, умеренный иммуносупрессивный эффект проявляют средние дозы глюкокортикостероидов.
Наиболее мощными иммуносупрессивными препаратами являются цитостатики — препараты, применяемые как противоопухолевые, в частности, антиметаболиты и алкилирующие соединения, антилимфоцитарные и моноклональные антитела (AT), антибиотики и др., которые называют «большими» иммуносупрессантами.
Классификация иммуносупрессивных лекарственных средств
а) алкилирующие — миелосан, циклофосфан;
б) антиметаболиты — азатиоприн, меркантопурин;
в) некоторые антибиотики — например актиномицин;
г) препараты ферментов — L-аспарагиназа.
4. Производные 4-аминохинолина — хингамин, гидроксихлорохин.
5. Препараты золота — кризанол, солганал, ауротиоглюкоза, ауронофин.
6. Производные кислоты микофолевой — целсепт и др.
Глюкокортикостероиды, как уже отмечалось, это уникальная группа препаратов, которая сочетает мощное противовоспалительное и иммунное воздействие, их иммуносупрессивное действие связано с влиянием на клетки лимфоидного ряда.
Глюкортикоиды подавляют реакцию клеток на лимфокины (фактор, активирующий макрофаги, фактор переноса и пр.), ограничивая этим клон сенсибилизированных клеток. Они нарушают инфильтрирование тканей клетками крови, в том числе моноцитами, предупреждая превращение их в макрофаги тканей. Имеет значение их способность стабилизировать мембраны лизосом, снижать в крови число циркулирующих в крови Т-лимфоцитов, особенно Т-хелперов, препятствуя этим их активности, кооперации с В-лимфоцитами и образованию иммуноглобулинов, угнетать активность макрофлагов, в частности продукцию ими ИЛ-1, увеличивать синтез белков, тормозящих латентные протеазы и фосфолипазу А,. Применяют их при лечении диффузных заболеваний соединительной ткани (ревматоидный артрит), обычно в сочетании с другими препаратами, и при других заболеваниях, в основе патогенеза которых лежит гиперчувствительность замедленного типа: красная волчанка, склеродермия, аутоиммунная гемолитическая анемия, неспецифический язвенный колит, аутоиммунный гломерулонефрит и др.
(Правила, согласно которым осуществляется лечение этими препаратами, их побочные эффекты освещены ранее.)
Цитостатические лекарственные препараты для достижения цитостатического или иммуносупрессивного эффекта применяют в соответствии с определенными клинико-фармакологическими принципами, а именно:
Алкилирующие иммуносупрессивные препараты — одна из наиболее распространенных групп цитостатиков, в основе механизма их действия лежит способность замещать атомы водорода в важных биологических структурах клеток на алкильную группу. При этом происходит необратимое угнетение жизнедеятельности клеток. Наиболее чувствительны к алкилирующим соединениям нуклеиновые кислоты. Препараты — миелосан, хлорбутин, циклофосфан действуют в любой фазе клеточного цикла и на клетку в состоянии покоя, проявляют преимущественное влияние на В-клетки, угнетают продукцию IgM.
Циклофосфан назначают в начальной дозе 200—400 мг, в случаях длительного применения — 75—100 мг в сутки. Иммуносупрессивный эффект развивается на 10-е сутки лечения. Хлорбутин применяют по 0,2 мг-кг»1 в сутки, в случае длительного лечения дозу уменьшают; иммуносупрессивный эффект развивается на 10—14-е сутки лечения.
Миелосан — цитотоксическое средство, действие которого проявляется преимущественно относительно клеток миелинового ряда, применяется при хроническом миелоцитарном лейкозе, настоящей полицитемии; в случае значительной тромбоцитемии при миелофиброзе. Относительная избирательность действия обусловливает беспечность его назначения в течение длительного времени. Препарат не следует применять при остром и подостром лейкозах, при обострении хронического лейкоза, при значительной тромбоцитопении.
Антиметаболиты. Меркаптопурин — антиметаболит пуринов, по химическому строению близок к этим соединениям, в связи с чем нарушает синтез нуклеотидов, нуклеиновых кислот, оказывает цитотоксическое действие, угнетает рост пролиферирующих тканей. По структуре и свойствам к меркаптопурину близок азатиоприн (имуран), у него больше проявляется иммуносупрессивное действие и меньше — цитоксичность. Применяют при аутоиммунных заболеваниях (ревматоидный полиартрит, системная красная волчанка), изредка — для предупреждения отторжения трансплантата при пересадке органов.
Меркаптопурин и азатиоприн проявляют наибольшую активность в индуктивной фазе иммунной реакции, их иммуносупрессивное действие приблизительно одинаково относительно как клеточного, так и гуморального иммунитета. Оба препарата вызывают лейкотромбоцитопению, диспепсические расстройства (тошноту, рвоту, анорексию), токсический гепатит. Азатиоприн больные переносят лучше, он реже, чем меркаптопурин, вызывает эрозии слизистой пищеварительного тракта и гипоплазию головного мозга. Обычная начальная суточная доза меркаптопурина — 2 мг/кг/1, в случае длительного лечения — 0,5—1 мг/кг/1, эффект повышается применением дозы 4 мг/кг в сутки, иммунодепрессивное действие обоих препаратов развивается через 20—60 сут от начала лечения.
Метотрексат, антагонист кислоты фолиевой, угнетает активность дигидрофолатредуктазы (РН,-редуктаза), образование кислоты тетрагидрофолиевой, необходимой для ресинтеза тиминметиловых групп и кислоты дезоксиуридиловой в пределах синтеза тимидилата. При этом нарушается удвоение ДНК. Применяют внутрь 2,5—5 мг в сутки; общая доза в неделю — от 10 до 20 мг. Иммуносупрессивный эффект развивается после введения 10—20 мл на 10—40-й день после начала лечения.
Важнейший представитель иммуносупрессивных препаратов среди противоопухолевых антибиотиков — актиномицин, угнетающий деление клеток, а также синтез РНК. Препарату свойственно значительное побочное действие, поэтому его не применяют для длительного лечения, однако он довольно эффективен для предупреждения отторжения почек или других органов после трансплантации. Вводят парентерально, суточная доза — 0,01— 0,02 мл/кг/1.
Циклоспорин (сандимун) — продукт обмена грибов группы Trichocterma polysporum, обладает значительным иммуносупрессивным эффектом, замедляет раннюю стадию диффенцирования Т-лимфоцитов, вызываемую антигеном, особенно сильно влияет на Т-хелперы, в результате чего угнетаются преимущественно реакции отторжения. Уменьшает образование интерлейкинов и интерферона. Применяют внутрь и внутривенно при реакциях гиперчувствительности замедленного типа: отторжения трансплантата при пересадке органов (почек, печени, сердца, легких, костного мозга), при некоторых аутоиммунных заболеваниях. В отличие от цитостатических средств, сандимун не оказывает отрицательного влияния на кроветворение. Проявляет нефро- и гепатотоксическое действие. Больные, получающие циклоспорин А, менее чувствительны к инфекционным агентам, чем те, которые применяют другие иммуносупрессоры. Иммуносупрессивные препараты оказывают на клетки иммунокомпетентной системы неспецифическое действие. Их влияние направлено на фундаментальные механизмы клеточного деления и ключевые этапы биосинтеза белка в разных клетках, в т. ч. иммунокомпетентных. Несмотря на универсальные цитостатистические свойства, иммунодепрессанты отличаются по направленности действия на определенные этапы иммуногенеза, что важно учитывать при выборе препарата, адекватного конкретной клинической ситуации. Практическое значение имеет деление иммуносупрессантов на три группы в зависимости от того, в какие сроки их необходимо вводить (относительно действия антигена) для иммуносупрессивного ответа.
Первая группа объединяет соединения, которые проявляют иммуносупрессивный эффект при введении перед антигенной стимуляцией или одновременно с ней. Они влияют на механизмы узнавания, переработки антигена и информации. К этой группе принадлежат глюкокортикостероиды, актиномицин С, некоторые алкилирующие соединения.
Вторая группа препаратов осуществляет иммуносупрессивное воздействие при введении через 1—2 дня после действия антигена, угнетая пролиферативную фазу иммунного ответа. При их введении в организм до антигена или больше чем через неделю после него иммуносупрессивный эффект не развивается. В эту группу входят антиметаболиты, алкалоиды барвинка (винкристин, винбластин), актинолицин, большинство алкилирующих соединений.
Третья группа содержит соединения, эффективные как до, так и после антигенного влияния, они имеют несколько точек приложения в цепи иммунного ответа. К этой группе относятся антилимфоцитарный глобулин (АЛГ), антитимоцитарный глобулин (АТГ), ионизирующее излучение, L-аспарагиназа и др.
Исходя из изложенного препараты первой группы следует применять в случае трансплантации органов, когда иммуносупрессия необходима для предупреждения реакции отторжения трансплантата. При аутоиммунных заболеваниях для угнетения процессов пролиферации, при длительном действии антигенов по типу цепной реакции лучше назначать препараты второй или третьей группы.
Учитывая большое количество осложнений, «большие» имуносупрессивные препараты не применяют в начале лечения аутоиммунной патологии. Как правило, при этом используют «малые» иммуносупрессанты. Поскольку большинство «больших» иммуносупрессантов незначительно влияет на эффекторные механизмы иммунного ответа, их часто комбинируют с НПВС или с глюкортикостероидами.
Определенное значение имеют производные 4-аминохинолина (хингамин, гидроксихлорохин), которые блокируют синтез нуклеиновых кислот. Препараты золота (кризанол, солганал, ауротиоглюкоза, ауронофин) стимулируют клеточные иммунные реакции и угнетают гуморальный иммунитет, их применяют для лечения ревматоидного артрита. Производные кислоты микофолевой (селлсепт) оказывают большее цитостатическое влияние на лимфоциты, чем на другие клетки, их назначают для профилактики отторжения тканей при пересадке почек.
Практически все препараты, проявляющие иммуносупрессивную активность, имеют широкий спектр действия, угнетая не только иммунокомпетентные клетки, но и другие пролиферирующие клетки, системы и отдельные органы (почки, печень). При их применении ослабляется противомикробный и противоопухолевый иммунитет, возрастает риск развития инфекционных осложнений и онкологических заболеваний. За последние годы проводят исследования по созданию с помощью генноинженерной технологии человеческих антител, которые имели бы узкий спектр действия на строго определенные клеточные популяции, на молекулы главного комплекса гистосовместимости, на антигенные рецепторы Т-клеток, на интерлейкины и их рецепторы и др. Применение подобных препаратов поможет целенаправленно влиять на необходимое звено иммунной системы.
Поскольку на данном этапе селективную иммунотерапию проводить невозможно, наилучшего терапевтического эффекта можно достичь при комбинированном использовании иммуносупрессивных средств. Применять иммуносупрессивные препараты следует только тогда, когда возможности другой терапии исчерпаны, а шансы на успех превышают риск иммуносупрессии.
Учитывая, что иммунные заболевания очень часто имеют неблагоприятный прогноз, противопоказания для проведения иммуносупрессивной терапии относительны. Особую осторожность следует проявлять при таких ситуациях: наличие инфекции, недостаточная функция костного мозга, снижение функции почек (угроза кумуляции), беременность, нарушение функций печени, глубокие нарушения иммунной системы, онкозаболевания.