Стафилококковый фаг чувствителен что это значит
Какой бактериофаг поможет в лечении? Определит лабораторный анализ
Какой бактериофаг поможет в лечении? Определит лабораторный анализ
Б актериофаги – уникальные микроорганизмы. Их антибактериальная активность достигается внедрением в клетку возбудителя, последующим размножением и распадом бактерии. Для лечения бактериальных заболеваний могут применяться либо антибиотики, либо бактериофаги, либо проводят совместную терапию. В каких случаях необходимо назначать антибиотики, а когда – бактериофаги? Все ответы в нашей статье.
Зачем делать анализ
Одна из ключевых проблем, послужившая развитию антибиотикорезистентности бактерий, – неправильное применение антибиотиков или противомикробных препаратов.
Когда к врачу обращается пациент с острым течением заболевания, антибиотики в большинстве случаев назначают сразу, без предварительного определения чувствительности возбудителя.
Специалист назначает антибиотик исходя из собственного опыта, учитывая рекомендации по активности препарата в отношении бактерий, наиболее часто вызывающих данное заболевание. Выбор антибиотика зачастую продиктован клинической ситуацией: необходимо устранить острые симптомы воспаления, что возможно только при ликвидации микроорганизма как причины, его вызывающей. Одновременно с назначением антибиотика врач направляет на анализ по определению чувствительности возбудителя к антибактериальным препаратам и бактериофагам. Результаты анализа обычно готовы в течение 3–4-х дней.
Важные требования к подбору антибактериального препарата на первом этапе: правильная дозировка, узкий спектр активности. Корректное назначение антибиотика определяет возможность формирования к нему устойчивости у бактерий. К сожалению, часто случается наоборот: некорректно назначенный препарат катализирует процесс мутаций у бактерий и формирует устойчивость их к антибиотикам.
Бактериофаги в отличие от антибактериальных препаратов воздействуют только на возбудителя заболевания, не затрагивая нормальную флору человеческого организма. Препараты бактериофагов можно принимать в сочетании с другими антибактериальными средствами, что усиливает противобактериальный эффект и позволяет снизить дозу антибиотика.
Совместное назначение бактериофагов с противовирусными препаратами противопоказано.
Чтобы достичь нужного эффекта при лечении любым антибактериальным препаратом и препаратом бактериофага, необходимо пройти тест на чувствительность возбудителя.
Как проводят тест
Принцип определения чувствительности бактерий к антибиотикам и бактериофагам одинаковый. На первом этапе работают с бактериями, выделенными из патологического содержимого – раны, мочи, мазка со слизистой. Далее в питательную среду добавляют антибиотики разных групп и бактерии.
Антибиотикограмму – перечень антибактериальных препаратов, к которым чувствителен выделенный возбудитель, получают с помощью современных стандартизованных методов: серийных разведений или диффузионных методов (диско-диффузионных и Е-тестов).
Расшифровка результатов анализа
На бланке теста будут обозначения в виде букв R или S. R (Resistant) – резистентность бактерий к данному бактериофагу или антибиотику, S (Sensitive) – чувствительность возбудителя к препарату.
Тест на антибиотико- и фагочувствительность помогает определить, справится препарат с возбудителем инфекции или нет. Это важный показатель, на который ориентируются специалисты при выборе схемы лечения.
АО «НПО «Микроген» выпускает широкий спектр бактериофагов, что расширяет возможности фаготерапии и позволяет корректно подобрать препарат, к которому чувствительны патогенные бактерии.
Посев на микрофлору и чувствительность микроорганизмов к фагам
Где проводится: Тонус
Срок выполнения: 5 рабочих дней
Для выполнения исследования на чувствительность к бактериофагам сначала выполняется микробиологический посев из интересующей локализации (мокрота, рана, ухо, нос, зев, кал итд.). Чувствительность к бактериофагам можно провести в том случае если в материале обнаружены те микроорганизмы к которым имеются соответствующие бактериофаги (стафилококки, стрептококки, энтерококки, дизентерийные бактерии, клебсиеллы, протей, сальмонеллы, синегнойная палочка).
Чувствительность к бактериофагам – микробиологическое исследование, направленное на выявление бактериофагов, к которым чувствительны патогенные бактериальные клетки.
Бактериофагами называют вирусы бактерий, которые способны проникать в клетку бактерий и уничтожать её (phagos – пожирать). При проникновении в бактериальную клетку бактериофаг приводит к лизису бактерий. Своего рода, бактериофаги — специфическая живая лекарственная форма против определенных видов бактерий. В медицине бактериофаги используют как один из дополнительных методов лечения некоторых инфекционных заболеваний совместно с антибиотиками. Например, для лечения заболеваний, вызванных патогенными микроорганизмами применяются соответствующие специфические бактериофаги: стафилококковый, стрептококковый, энтерококковый, колипротейный, специфический для дизентерийных бактерий (дизентерийный поливалентный против шигелл Флекснера и Зонне), клебсиелл, сальмонелл, синегнойной палочки. Бактериофаги производятся фармакологической промышленностью в различных формах (жидкие, таблетированные).
Исследование не следует проводить на фоне применения антибактериальных препаратов.
— один из дополнительных методов лечения гнойных ран, циститов, флегмон, маститов, дизентерии, энтероколитов, хронических остеомиелитов и ряда других инфекционных заболеваний.
— при выделении у пациента лекарственно-устойчивых микроорганизмов (особенно к антибактериальным препаратам широкого спектра действия),
Результаты определения чувствительности микроорганизмов к фагам:
Чувствительность микробиоты кишечника к бактериофагам и пробиотикам у детей с заболеваниями органов пищеварения
В современной детской гастроэнтерологии используется широкий арсенал препаратов для коррекции нарушенного микробиоценоза кишечника [1, 2]. В последние годы появились пациенты с антибиотикоассоциированными формами дисбактериоза (например, после проведения
.jpg)
В клинической практике педиатры и гастроэнтерологи для коррекции дисбактериоза всe чаще используют перспективные штаммы микробов в составе пробиотических препаратов [7, 8]. Штаммы должны быть типичными для данной возрастной группы детей, они должны сохранять длительную жизнеспособность при хранении и в процессе продвижения по желудочно-кишечному тракту. Одним из важнейших их свойств должна быть способность к адгезии на поверхности эпителиоцитов кишечника, что позволяет им колонизировать желудочно-кишечный тракт. Штаммы должны обладать высокой антагонистической активностью по отношению к патогенным организмам, обладать иммуномодулирующими свойствами [9]. При применении такой пробиотик не должен вызывать побочных эффектов и нарушений со стороны желудочно-кишечного тракта.
В современных условиях при широком арсенале пробиотиков чаще используются те препараты, которые рекомендованы хорошо обеспеченной рекламой от фирм-производителей или поставщиков. Долговременное использование одних и тех же пробиотиков и бактериофагов ведeт к изменению чувствительности условно-патогенных микроорганизмов [10, 11]. Отслеживание еe чувствительности в детской популяции является важной задачей клинической практики.
Цель исследования. Определить лабораторную чувствительность или резистентность микрофлоры кишечника у детей с гастроэнтерологической патологией и синдромом дисбактериоза к препаратам, назначаемым для его коррекции, прежде всего к антимикробным средствам, а также к бактериофагам и пробиотикам.
Материалы и методы. Под наблюдением находилось 65 детей в возрасте от 3 месяцев до 10 лет, из них от 3 месяцев до 3 лет — 10 детей, от 3 до 6 лет — 25 и 7–10 лет — 30. В младшей возрастной группе были больные с глистно-протозойной инвазией (15) и кожно-интестинальной аллергией (20). У детей 7–10 лет основным диагнозом был хронический гастродуоденит (ХГД) (поверхностный тип — у 20 больных, эрозивный — у 10). У всех детей с ХГД в течение последнего полугодия определялась Нр(+)-ассоциация, по поводу чего проводилась тройная антихеликобактерная терапия (Гастрозол, Амоксициллин, Клацид). На фоне тройной терапии больные получали пробиотическую поддержку (Бифиформ или Линекс).
В комплекс обследования включались оценка клинико-анамнестических данных, показателей клинического минимума (анализ крови, мочи, копрограммы), УЗИ органов брюшной полости, фиброгастродуоденоскопия (по показаниям). Всем больным с кожно-интестинальной аллергией проводилось биорезонансное тестирование на сенсибилизацию к пищевым и ингаляционным аллергенам. Исследование кала на лямблии проводилось методом эфирно-формалинового обогащения, микробиологический анализ кала на дисбактериоз кишечника с определением чувствительности выделенной флоры к четырем антимикробным препаратам (Метронидазол, Макмирор, Эрсефурил, Интетрикс), к шести видам бактериофагов (БФ) и 9 пробиотическим препаратам. Чувствительность или резистентность кишечной микрофлоры определялась к следующим фаголизатам: клебсиеллeзный поливалентный БФ, интести-БФ, колипротейный БФ (Н. Новгород), комплексный ПИО-БФ (Н. Новгород), ПИО-ПОЛИ БФ (Уфа) и Секстафаг (Пермь). Оценивалась также чувствительность кишечной микробиоты к 9 пробиотическим препаратам: Бифиформ, Линекс, Нормофлорин, Аципол, Лактобактерин, Бифидумбактерин, Ламинолакт, Пробифор, Примадофилус. При выделении дрожжеподобных грибов рода Candida albicans определялась чувствительность к антимикологическим средствам (Пимафуцин, Нистатин, Дифлюкан и др.).
Подготовка материала для бактериологического исследования проводилась с соблюдением следующих условий: взятие материала из утренней порции, доставка в лабораторию не позднее двух часов с момента дефекации. Бактериологические анализы с определением чувствительности выделяемых микроорганизмов из кишечника проводились в лаборатории «Диагностика» Института экспериментальной медицины (Санкт-Петербург).
Результаты. У всех обследованных детей в 100% случаев обнаруживались бактериологические признаки дисбактериоза. Для оценки тяжести дисбактериоза выделялись бактериологические признаки: снижение количества или исчезновение бифидофлоры, лактобактерий; снижение полноценной кишечной палочки; увеличение количества штаммов гемолитической кишечной палочки; изменение общего количества кишечной палочки; изменение количества энтерококков и наличие условно-патогенной флоры (энтеробактерий, кокков, дрожжеподобных грибов и др.) [12]. С учeтом числа выделенных бактериологических признаков и по соотношению в микробиологическом анализе анаэробы/аэробы у больных был диагностирован дисбиоз средней степени тяжести (71,5%) и I и III степени тяжести (25% и 8,5% соответственно). Степень тяжести дисбиоза является интегративным показателем, который характеризуется нарушением нормальных соотношений основных популяций микроорганизмов кишечника.
Что касается основных компонентов биоценоза, то следует отметить снижение титра бифидобактерий у 55,5% пациентов, нормальные показатели титра бифидобактерий были у 44,5%. Снижение же титра лактобактерий и колифлоры у обследованных детей было более значимым и выявилось у 82,2% и 93,5% соответственно. Нормальные показатели титров лактобактерий и колифлоры были у меньшего числа пациентов (у 17,8 и 4,5% соответственно). Не столь значительное снижение титра бифидобактерий обусловлено тем, что в недалeком прошлом у пациентов при проведении тройной антихеликобактерной терапии и назначении антипротозойной терапии использовался в комплексной терапии кислотоустойчивый штамм бифидобактерий БАГ 791. Однако общее содержание кишечной палочки и еe полноценных штаммов было значительно сниженным (у 95,5% и 80% детей соответственно). Только у 5% обследованных детей не было роста в бактериологическом анализе условно-патогенной флоры. Чаще всего определялся высев клостридий (33,8%), грибов рода C. albicans (20%), золотистого стафилококка (20%) и энтеробактерий — Klebsiella pneumoniae и K. oxytoca (17%), гемоштаммов Escherichia coli и Citrobacter spp. (14,3% и 5,7% пациентов). При анализе чувствительности выделенной микрофлоры к антимикробным препаратам, а именно к метронидазолу и нифуроксазиду (Эрсефурил), отмечена высокая степень резистентности (к метронидазолу 100% резистентность, к нифуроксазиду 85% пациентов). Следует отметить, что у наблюдаемых детей именно данные медикаменты использовались либо для санации от лямблиоза, либо для коррекции дисбактериоза, однако, используя их, санационного эффекта достигнуть не удавалось. Выделенная грамположительная и грамотрицательная микрофлора сохраняла 100% чувствительность к Макмирору и Интетриксу. Следовательно, эмпирический выбор антимикробных препаратов на этапе подавления микробной флоры при дисбактериозе без учeта лабораторной чувствительности не всегда позволяет получить положительный лечебный эффект.
Другая группа препаратов направленного действия — это БФ. Определение чувствительности микроорганизмов проводилось к шести разновидностям БФ. Наибольшая частота чувствительности условно-патогенных микроорганизмов выявилась к Секстафагу (Пермь) — 50% и Пиобактериофагу комплексному (Н. Новгород) — 43%. К остальным видам БФ: интести-БФ, колипротейному БФ (Н. Новгород), клебсиеллeзному и ПИО-ПОЛИ БФ (Уфа) чувствительность выделенных микроорганизмов в лабораторном тесте не превышала 25%, в то время как резистентность условно-патогенной флоры к различным видам БФ колебалась от 50% до 78%. Поэтому для коррекции дисбиоза применение БФ целесообразно использовать после определения чувствительности выделенной кишечной флоры к бактериофагам.
Ведущее значение в программах коррекции дисбактериоза у детей имеют пробиотики, они нередко назначаются как стартовые препараты в расчeте на их антагонистические свойства или на этапе восстановления микробиоценоза. Определение чувствительности микроорганизмов, выделяемых из кишечника при дисбактериозе у детей, проводимое лабораторным тестированием к пробиотикам, выявило интересные закономерности. Анализ полученных результатов исследований показал, что часто используемые препараты (Бифиформ, Линекс, Нормофлорин) утратили антагонистические свойства, определялась 100% резистентность условно-патогенных микроорганизмов к Бифиформу и Нормофлорину и в 95,5% случаев была резистентность к Линексу. Что касается чувствительности микробной флоры к Ациполу, Лактобактерину, Ламинолакту и Пробифору, то она колебалась от 68% до 86%. Самая высокая (100%) чувствительность условно-патогенных бактерий (грамположительных и грамотрицательных) выявилась к пробиотику Примадофилус; при сочетании в культуре бактериальных микроорганизмов с C. albicans у Примадофилуса определялась промежуточная чувствительность только к грибам.
Препарат Примадофилус в линейке пробиотиков, на наш взгляд является несомненным лидером. Во-первых, удобная порошковая форма, с хорошей переносимостью, достаточным количеством препарата в одной упаковке на полный курс лечения. Во-вторых, препарат обладает широким спектром действия и на грамположительную и грамотрицательную микрофлору, высокой (100%) чувствительностью условно-патогенной флоры к данному пробиотику и полным отсутствием аллергических реакций. Примадофилус содержит смесь лактобацилл (Lactobacillus acidophilus и L. rhamnosus) и бифидобактерий (Bifidobacterium infantis и B. longum), дополнительным компонентом служит мальтодекстрин, в составе нет лактозы, в отличие от большинства других препаратов. Синбиотик Примадофилус детский является препаратом выбора для коррекции микробиоты у детей с кожно-интестинальной аллергией.
Заключение. Определение чувствительности микроорганизмов при нарушенном микробиоценозе у детей позволяет оптимизировать коррекцию дисбактериоза как на этапе подавления условно-патогенной флоры, так и на последующих этапах восстановления микробиоты до нормобиоценоза. Выбор эффективных препаратов (антимикробных средств, бактериофагов, пробиотиков) позволяет сократить сроки коррекции нарушенного микробиоценоза и избежать возможных побочных их действий.
Синбиотик Примадофилус имеет преимущества в коррекции бактериальных ассоциаций в микробиоценозе по сравнению с Бифиформом, Линексом, Нормофлорином. При высеве грибов рода C. albicans до назначения Примадофилуса следует использовать антимикотические средства.
Литература
*СПбМАПО, **Лаборатория «Диагностика» ИЭМ, Санкт-Петербург
Контактная информация об авторах для переписки: Консультативно-диагностический центр для детей №2, Санкт-Петербург, ул. Гладкова, д. 4, 198099
Определение чувствительности Staphylococcus spp.
При оценке чувствительности Staphylococcus spp. в первую очередь необходимо тестировать препараты, имеющие основное клиническое значение: бета-лактамы, макролиды, фторхинолоны, аминогликозиды и ванкомицин.
Критерии интерпретации результатов определения чувствительности Staphylococcus spp. (пограничные значения диаметров зон подавления роста и МПК АБП) приведены в таблице 14.
Таблица 14.
Бета-лактамы
Препаратами выбора для лечения стафилококковых инфекций (вызванных как Staphylococcus aureus, так и коагулазанегативными стафилококками) являются бета-лактамные антибиотики, следовательно, в первую очередь необходимо определять чувствительность стафилококков к этим препаратам.
Таким образом, определение чувствительности Staphylococcus spp. к бета-лактамным АБП должно включать выполнение двух тестов:
Определение чувствительности к бензилпенициллину или выявление продукции бета-лактамаз (пенициллиназ)
Определение чувствительности Staphylococcus spp. к бензилпенициллину несколько затруднено тем фактом, что синтез бета-лактамаз у этого микроорганизма является индуцибельным процессом (продукция фермента усиливается после контакта с антибиотиком). В результате этого при использовании стандартных методов серийных разведений и ДДМ возможно получение результатов ложной чувствительности.
Решением данной проблемы может быть использование метода непосредственного выявления бета-лактамаз, основанного на использовании дисков с нитроцефином. Нитроцефин представляет собой хромогенный цефалоспорин, который легко гидролизуется под действием всех бета-лактамаз с образованием окрашенного продукта.
Постановка теста
Для проведения исследования используют чашку, на которой оценивали чувствительноcть исследуемого штамма Staphylococcus spp. к пенициллину и/или оксациллину ДДМ. С границы зоны ингибиции роста вокруг диска с оксациллином бактериологической петлей забирается незначительное количество культуры и наносится на предварительно увлажненный диск с нитроцефином. Диск инкубируют при комнатной температуре до 1 ч.
Интерпретация результатов
Появление красного окрашивания свидетельствует о продукции бета-лактамаз исследуемым штаммом микроорганизма.
Штамм, продуцирующий бета-лактамазу, рассматривают как устойчивый к природным и полусинтетическим пенициллинам (за исключением оксациллина) независимо от конкретных результатов тестирования к перечисленным АБП.
Определение чувствительности к оксациллину
При определении чувствительности к оксациллину стандартными методами необходимо учитывать некоторые особенности:
Особенности тестирования ДДМ
Особенности тестировании методами серийных разведений
Интерпретация результатов тестирования стафилококков к оксациллину
Выдача клиницистам результатов исследования и рекомендаций по лечению
Дополнительные методы выявления метициллинорезистентности
В то же время скрининг на агаре для выявления метициллинорезистентности является высоко чувствительным и специфичным методом, легко выполнимым в условиях рутинной работы микробиологической лаборатории, однако он может быть использован только для штаммов S.aureus.
Постановка теста
Инокуляция
Для инокуляции чашек с агаром можно использовать два метода: с помощью микропипетки или с помощью стерильного ватного тампона.
Метод I (микропипеткой)
Метод II (с помощью тампона)
Инкубация
Учет результатов
После инкубации чашки тщательно просматривают в проходящем свете:
Контроль качества
Макролиды и линкозамиды
Макролиды и линкозамиды являются альтернативными препаратами для лечения стафилококковых инфекций. В исследование необходимо включать:
Приведенный выбор препаратов определяется закономерностями перекрестной резистентности между антибиотиками указанных подгрупп.
Фторированные хинолоны
Аминогликозиды
На практике необходимо учитывать некоторые особенности интерпретации результатов, полученных in vitro. Так, при детекции устойчивости к гентамицину выделенный штамм следует рассматривать как устойчивый ко всем аминогликозидам. В этой связи гентамицин должен включаться в набор для тестирования в обязательном порядке. В тоже время крайне редко могут встречаться штаммы, устойчивые к другим аминогликозидам при чувствительности к гентамицину.
Ванкомицин
Ванкомицин является одним из препаратов выбора (наряду с оксазолидинонами) для лечения инфекций, вызываемых оксациллинрезистентными штаммами. Появление сообщений об устойчивости стафилококков к гликопептидам требует внимательного отношения к оценке результатов исследования.
Дополнительные препараты
Линезолид
Оксазолидиноны являются важным достижением в лечении инфекций, вызываемых оксациллинрезистентными штаммами, в том числе и устойчивыми к гликопептидам. В то же время, необходимо иметь ввиду, что уже известно о формировании устойчивости к антибиотикам этой группы.
Другие препараты
Значение перечисленных препаратов в лечении стафилококковых инфекций, вызванных метициллинчувствительными штаммами, невелико, так как они уступают по активности бета-лактамам. Их клиническая эффективность при инфекциях, вызываемых оксациллинрезистентными штаммами, изучена недостаточно.
Рифампицин, ко-тримоксазол и фузидиевую кислоту нельзя рекомендовать как средство монотерапии из-за высокой частоты селекции резистентности в процессе лечения.
Бактериофаги – альтернатива антибиотикам или помощь им?
В 1896 г. британский химик Э. Ханкин, изучая антибактериальное действие вод индийской реки Ганг и в 1898 году российский ученый Н. Ф. Гамалея впервые наблюдали и описали уничтожение бактерий другими «агентами», а в 1917 году ученым Ф.Д. Эрелем из института Пастера в Париже были открыты микроорганизмы, которые питаются бактериями. Именно он предложил назвать их бактериофагами – пожирателями бактерий. Бактериофаги являются абсолютными внутриклеточными паразитами бактерий разного вида.
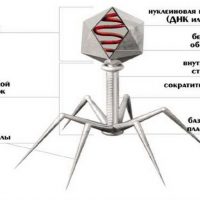
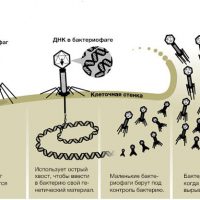
Бактериофаги еще в прошлом столетии доказали свою эффективность и безопасность. Почему же бактериофаги до сих пор не стали основными средствами борьбы с инфекцией? Это объясняется несколькими причинами. Главная — открытие новой группы препаратов – антибиотиков, надолго оттеснившее интерес к бактериофагам. Плюс:
Что такое бактериофаги
В 1939 году А. Флемингом был открыт антибиотик, и началась эра антибиотиков в лечении бактериальных инфекций. Появилось большое количество антибиотиков 1, 2, 3, 4 поколений, причем антибиотики последнего поколения, которыми пользуются и сейчас, появились еще в 70-е годы прошлого столетия. На Западе и Америке отказались от бактериофагов и активно начали применять антибиотики.
Но А. Флеминг предупреждал о некоторых обязательных моментах применения антибиотиков:
Несоблюдение хотя бы части этих требований могло привести и, как оказалось, приводит к кризису антибиотиковой эры. Бактерии перестают реагировать на препараты. Пока ещё действуют антибиотики последнего поколения, решая труднейшие клинические проблемы, но рассчитывать на появление новых антибиотиков не приходится.
Россия на сегодняшний день оказалась самой развитой страной в области микробиологии изучения бактериофагов. Бактериофаги – это естественные антагонисты бактерий.
Каков механизм действия бактериофагов
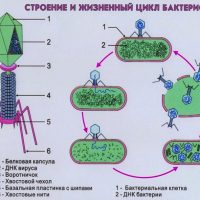
В организме человека бактериофаги попадают в очаг инфекции, там размножаются до тех пор, пока есть «свои» бактерии, и затем выводятся естественным путем.
Сегодня многие заболевания вызываются стафилококками, стрептококками, клебсиеллами и другими бактериями, и успешно могут лечиться бактериофагами. Это естественная альтернатива антибиотикам, возврат к природе.
Какие преимущества имеют бактериофаги в лечении бактериальных инфекций
Бактериофаги много тысяч лет делали свое дело, не давая бактериям уничтожить все живое на земле.
Бактериофаги могут применяться и у беременных, и у детей, во всех возрастных группах людей. Противопоказаний к их применению нет.
Фаги совместимы с различными лекарствами, в том числе с антибиотиками, причем они уменьшают непереносимость (резистентность) бактерий к антибиотикам.
Курс лечения бактериофагами более короткий (7-14 дней). Фаги практически не дают побочных явлений. Они определяются бактериальной зараженностью и распадом бактерий с выделением эндотоксина, но они значительно меньше, чем при приеме антибиотиков, эти явления легко снимаются приёмом энтеросорбентов. Бактериофаги можно применять при аллергических реакциях на антибиотики.
Бактериофаги, благодаря своей специфичности воздействия на бактерии, не убивают хорошие бактерии и не изменяют нормальную микрофлору кишечника. Они, в отличие от антибиотиков, не нарушают микробиом человека.
Какие виды бактериофагов известны
Известно, что бактериофаги действуют на один штамм бактерий, поэтому производятся препараты бактериофагов, действующих против разных штаммов одного возбудителя:
Особенность бактериофагов – узкая специфичность, в следствие чего они могут применяться против определенных штаммов бактерий, поэтому необходимо иметь большую коллекцию бактериофагов, из которой можно выбрать подходящий препарат или фаговый коктейль для конкретного пациента. Коллекция бактериофагов составляет более 200 препаратов.
Производителем бактериофагов в России является научно-производственное объединение Микроген — мировой лидер изучения бактериофагов.
При каких заболеваниях применяются бактериофаги
Бактериофаги применяются при:
Инфекции желудочно-кишечного тракта, вызванные сальмонеллой, золотистым стафилококком, протеем, и др. и сопровождающиеся диареей (поносами), успешно лечатся бактериофагами.
Применяться бактериофаги при острых кишечных инфекциях могут:
Используются бактериофаги в дерматологии, в детской практике, хирургии. С профилактической целью — в детских садах и школах для предотвращения эпидемий, например, дизентерии. Бактериофаги уже более 100 лет на службе человека. Может быть, как раз сейчас начинается эпоха бактериофагов. В новосибирском научном центре разрабатываются технологии персонализированного лечения. Медицинские центры Франции, Бельгии, Швейцарии проводят клинические исследования коктейлей бактериофагов.
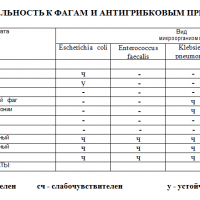
| Участок заражения | Обследование |
| желудочно-кишечный тракт | анализ на микробиом толстой кишки (на дисбактериоз) |
| носоглотка | мазок на микрофлору |
| урологические заболевания | посев мочи, посев секрета простаты |
| гинекологические заболевания | мазки |
| раневые поверхности и язвы, в том числе при диабетической стопе | посев |
В настоящее время при выявлении бактериального возбудителя болезни есть возможность определить его чувствительность к бактериофагу. Перед началом лечения необходимо пройти это обследование.
Как принимаются бактериофаги
Бактериофаги хранятся в холодильнике при температуре 2-8 градусов.
Бактериофаги — это крупные частицы. Они трудно проникают в ткани органов, поэтому лучше вводить их при лечении прямо к месту локализации инфекции. Это могут быть ингаляции при легочной патологии, промывания при лор-заболеваниях, аппликации при трофических язвах, ожогах, ранах. При инфекциях мочевыводящих путей для достижения успеха препараты бактериофагов вводятся в полость мочевого пузыря (хронический цистит).
Для внутреннего употребления есть бактериофаги во флаконах по 20 мл, 4 флакона в упаковке. Перед употреблением флакон следует подержать в руке, согреть, перелить в чистую посуду и принять внутрь. Принимать 2 раза в день натощак и после ужина, курс лечения 6 дней.
В настоящее время проводят лечение бактериофагами диабетической стопы. Из больных тканей берут мазок для выявления конкретных патогенных бактерий. Затем из коллекции бактериофагов подбирают те, которые способны ликвидировать именно эти бактерии. Бактериофаг наносят на стерильную салфетку, прикладывают к ране. Лечение около недели.
Бактериофаги применяются в медицине местно или внутрь. Еще в 30-ые годы прошлого столетия бактериофаги доказали свою безопасность и высокую эффективность в клинических условиях. Но покупать бактериофаги и лечиться самостоятельно не стоит.
Заключение
Не всегда бактериофаги могут заменить антибиотики. Так, если имеет место острая ситуация, когда заподозрена бактериальная инфекция, но нет времени определить бактериальный фон болезни, чтобы подобрать препарат бактериофаг, то применяется лечение антибиотиками. При хронических инфекционных болезнях, когда установлена нечувствительность бактерий к антибиотикам и бактериальный фон заболевания, предпочтение следует отдать бактериофагам.
Хотя бактериофаги, возможно, не смогут полностью заменить антибиотики, но вместе они могут бороться со многими серьезными болезнями в клинической практике.