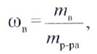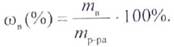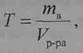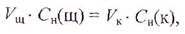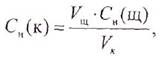приготовить раствор молярной концентрации
ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ



Растворами называются гомогенные системы переменного состава, состоящие из двух или большего числа компонентов и продуктов их взаимодействия.
Под компонентами подразумеваются растворенные вещества и растворитель.
Важнейшей характеристикой раствора является концентрация.
В зависимости от целей использования раствора применяют различные способы выражения концентрации, основные из которых рассмотрены ниже.
1. Массовая доля и процентная концентрация
Массовой долей (ω) называется отношение массы растворенного вещества к массе раствора:
При выражении этой величины в процентах она называется
2. Молярная концентрация (молярность)
Молярная концентрация (См)- это отношение количества (числа молей) вещества к объему раствора, выраженному в литрах.
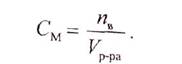 |
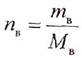 |
— количество вещества (моль), то:
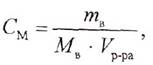 |
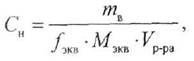
3. Молярная концентрация эквивалента (нормальность)
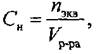 |
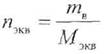 |
— количество эквивалентов вещества, моль.
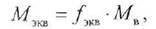 |
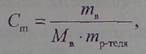 |
| 4. Моляльная концентрация (моляльность) |
| Моляльная концентрация (Cm) определяется числом молей растворенного вещества в 1000 граммах (1 кг) растворителя: |
Титр раствора (7) определяется массой растворенного вещества в 1 мл раствора:
где Т—титр раствора, г/мл;
Опыт 1. Приготовление раствора соляной кислоты заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
Для определения концентрации раствора исходной соляной кислоты измерьте ареометром ее плотность (ρ, г/см ). Для этого кислоту налейте в цилиндр, опустите в нее ареометр. Отметьте деление шкалы ареометра, совпадающее с нижним мениском жидкости в цилиндре. Это и есть плотность раствора. Пользуясь табл. 1, определите процентную концентрацию исходной соляной кислоты (ωисх, %).
Далее рассчитайте (с точностью до десятых долей миллилитра) объем исходной кислоты, необходимый для приготовления 100 мл раствора с концентрацией, указанной преподавателем. Проверьте правильность расчета, показав его преподавателю.
Раствор готовится в мерной колбе объемом 100 мл. Мерную колбу примерно наполовину заполните дистиллированной водой.
Отберите вычисленный объем исходной кислоты в
несите кислоту в мерную колбу. Аккуратно доведите объем раствора до риски дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Таблица 1 растворов некоторых кислот и оснований при 20°С
| Массовая доля, % | Н2SO4 | HNO3 | HCI | NaOH | NH3 |
| 1.012 | 1,009 | 1.008 | 1,021 | 0.990 | |
| 1,025 | 1,020 | 1,018 | 1,043 | 0,981 | |
| 1,038 | 1,031 | 1,023 | 1,065 | 0,973 | |
| 1,052 | 1,043 | 1,038 | 1,087 | 0,965 | |
| 1,066 | 1,054 | 1,047 | 1,109 | 0,958 | |
| 1,080 | 1,066 | 1,057 | 1,131 | 0,950 | |
| 1,095 | 1,078 | 1,069 | 1,153 | 0,943 | |
| 1,109 | 1,090 | 1,078 | 1,175 | 0,936 | |
| 1,124 | 1,103 | 1,088 | 1,197 | 0,930 | |
| 1,139 | 1,115 | 1,098 | 1,219 | 0,923 | |
| 1,155 | 1,128 | 1,108 | 1,241 | 0,916 | |
| 1,170 | 1,140 | 1,119 | 1,263 | 0,910 | |
| 1,186 | 1,153 | 1,129 | 1,285 | 0,904 | |
| 1,202 | 1,167 | 1,139 | 1,306 | 0,898 | |
| 1,219 | 1,180 | 1,149 | 1,328 | 0,892 | |
| 1,235 | 1,193 | 1,158 | 1,349 | 0,886 | |
| 1,252 | 1,207 | 1,169 | 1,370 | ||
| 1,268 | 1,221 | 1,179 | 1,390 | ||
| 1,286 | 1,234 | 1,189 | 1,410 | ||
| 1,303 | 1,246 | 1,198 | 1,430 | ||
| 1,321 | 1,259 | 1,449 | |||
| 1,337 | 1,272 | 1,469 | |||
| 1,357 | 1,285 | 1,487 | |||
| 1,376 | 1,298 | 1,507 | |||
| 1,395 | 1,310 | 1,525 | |||
| 1,415 | 1,322 | 1,543 | |||
| 1,435 | 1,334 |
Опыт 2. Определение концентрации кислоты методом титрования
Перед началом титрования бюретку сполосните раствором щелочи, выданным для работы. Нормальность раствора щелочи указана на этикетке склянки.
Заполните бюретку щелочью несколько выше нулевого деления. Установите уровень щелочи (по нижнему мениску) на нулевом делении бюретки. Если нулевая отметка находится значительно выше уровня глаз, титрование можно вести от другого деления, например от 10 мл.
Проведите ориентировочное титрование. Для этого в пипетку с помощью груши наберите 10 мл (аликвотную часть) приготовленного раствора кислоты. Из пипетки кислоту вылейте в коническую колбу для титрования, внесите туда 2-3 капли индикатора фенолфталеина. Из бюретки по каплям прилейте щелочь, постоянно перемешивая содержимое колбы кругообразными движениями. Титрование проведите на белом фоне, подложив под колбу лист белой бумаги. Как только раствор станет от прибавления одной капли щелочи бледно-розовым, добавление щелочи прекратите и запишите объем щелочи, пошедший на титрование.
Титрование надо будет повторить еще два раза. Каждый раз перед титрованием новой пробы кислоты подливайте щелочь в бюретку до нулевой отметки или до того уровня, с которого начали титровать в первом опыте. После каждого титрования объем щелочи с точностью до десятых долей миллилитра записывайте в таблицу. Эти объемы не должны отличаться более чем на 0,1 мл. Если результаты титрования отличаются на большую величину, титрование следует повторить.
Рассчитайте нормальную концентрацию приготовленного раствора кислоты, используя закон эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах, т. е. число эквивалентов щелочи, пошедшее на титрование (Nщ), равно числу эквивалентов кислоты, взятой для анализа (NK):
Число эквивалентов растворенного вещества в данном объеме раствора (V) равно произведению объема раствора на его нормальность, т. е.
где V- объем раствора, л;
При оформлении результатов опыта:
1. Запишите плотность (рисх) и процентную концентрацию (ωиех, %) исходного раствора.
2. Приведите расчет объема исходной кислоты (Vисх), необходимого для приготовления заданного раствора,
3. Запишите объем кислоты, взятый для титрования (объем пипетки, Vк), нормальность раствора щелочи Сн(щ). Затем заполните табл. 2.
Опыт 3. Приготовление раствора соли с заданной массо
вой долей (ω соли, %)
Получите у преподавателя задание. Рассчитайте, сколько
граммов соли и какой объем воды потребуются для приготовления
100 мл раствора соли заданной концентрации.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в мерную колбу, предварительно налив в нее небольшой объем воды. Затем дистиллированной водой доведите объем раствора в колбе до метки (воду необходимо приливать постепенно, все время перемешивая раствор). Приготовленный раствор из колбы отлейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью табл. 3 определите массовую долю соли в приготовленном растворе. (Совпадает ли она с рассчитанной вами?)
Таблица 3 Плотность растворов некоторых солей при 20°С
| Массовая доля, % | NaCl | KCl | NH4C1 | Na2S04 | (NH4)2SO4 | A12(S04)3 | Na2SO4.10H2O |
| 1,007 | 1,05 | 1,01 | 1,007 | 1,004 | 1,009 | 1,004 | |
| 1,014 | 1,011 | 1,004 | 1,016 | 1,010 | 1,019 | 1,008 | |
| 1,022 | 1,017 | 1,008 | 1,026 | 1,016 | 1,029 | 1,012 | |
| 1,029 | 1,024 | 1,011 | 1,035 | 1,022 | 1,040 | 1,016 | |
| 1,036 | 1,030 | 1,014 | 1,044 | 1,028 | 1,050 | 1,020 | |
| 1,044 | 1,037 | 1,017 | 1,053 | 1.034 | 1,061 | 1,024 | |
| 1,051 | 1,043 | 1,020 | 1,063 | 1.040 | 1,072 | 1,028 | |
| 1,058 | 1,050 | 1,023 | 1,072 | 1,046 | 1,083 | 1,032 | |
| 1,065 | 1,056 | 1,026 | 1,082 | 1,051 | 1,094 | 1,036 | |
| 1,073 | 1,063 | 1,029 | 1,091 | 1,057 | 1,105 | 1,040 | |
| И | 1,081 | 1,070 | 1,031 | 1,101 J | 1,063 | 1,117 | 1,044 |
| 1,089 | 1,077 | 1,034 | 1,111 | 1,06 | 1,129 | 1,048 | |
| 1,096 | 1,083 | 1,037 | 1,121 | 1,075 | 1,140 | 1,052 | |
| 1,104 | 1,090 | 1,040 | 1,131 | 1,081 | 1,152 | 1,056 | |
| 1,119 | 1,104 | 1,046 | 1,141 | 1,092 | 1,176 | 1,064 | |
| 1,135 | 1,113 | 1,051 | 1,104 | 1,201 | 1,072 | ||
| 1,143 | 1,126 | 1,054 | 1,109 | 1,213 | 1,077 | ||
| 1,151 | 1.133 | 1,057 | 1,115 | 1,226 | 1,081 | ||
| 1,159 | 1,140 | 1,059 | 1,121 | 1,239 | 1,085 | ||
| 1,062 | 1,127 | 1,252 | |||||
| 1,067 | 1,257 | ||||||
| 1,073 | 1,306 | ||||||
| 1,333 |
Рассчитайте молярную, нормальную концентрации и титр приготовленного раствора. Результаты опыта сведите в табл. 4.
Результаты опыта приготовления раствора соли
| Масса, г | Плотность раствора, р, г/мл | Концентрация Приготовленного раствора соли | ||
| соли | воды | молярная, См, моль/л | нормальная, Сн, моль/л | титр, г/мл |
Задания для самоконтроля
1. Содержание сульфата железа (II) в растворе (пл. 1,122 г/см )
составляет 12%. Вычислите молярную концентрацию и молярную
концентрацию эквивалента сульфата железа (И) в растворе.
2. На нейтрализацию 50 мл раствора КОН пошло 10 мл 0,8н раствора НС1. Рассчитайте нормальность раствора щелочи.
3. Для приготовления 0,025М раствора хлорида кальция используют СаСl2 в ампулах с массовой долей 0,45% (пл. 1,04 г/см).
Сколько мл этого раствора необходимо для приготовления 500 мл 0,02 5М раствора?
Урок 15. Моляльность и молярность
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Растворитель и растворенное вещество
Расчет концентрации раствора
Молярная концентрация
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
Число молей растворенного сульфата аммония равно:
Завершающий шаг! Молярность раствора равна:
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Число молей уксусной кислоты в 5 г равно:
Масса 1 л этанола равна:
Последний этап. Найдем моляльность полученного раствора:
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
где с 1 и V 1 — молярная концентрация и объем раствора до разбавления, с 2 и V 2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Молярная концентрация
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.