почему после еды начинаются экстрасистолы
Аритмия экстрасистолия после приема пищи
Здравствуйте, помогите пожалуйста. Мучает дикая аритмия замирания пульса после приема пищи, внутри все кувыркается дергается все это сопровождается паническим страхом что сердце остановится.До проявления этого симптома уже 4 года мучаюсь с разного рода ощущениями в грудной клетке в шее, в начале этого года добавилось головокружение и вот уже месяц как мучает дикий рваный пульс после приема пищи и это может быть нормальный обед,а может проявиться и после совсем небольшого количества пищи. До этого делал кучу обследований холтер,ВЭМ, УЗИ сердца ЭКГ штук сто и ничего не нашли. Сначала прицепились к весу,курению и давлению 140/90, мол все дело в этом, я бросил курить уже три года, сбросил 30кг, давление по дневнику 115\75 до 130/90 но становится не лучше. Обращался к неврологу два года назад и мне поставили ПА невроз остеохондроз но дальнейшее лечение результатов не дало и у меня опустились руки, а сейчас ко всему добавился еще один симптом и не знаю уже к кому обращаться. Недавно опять ходил на ВЭМ и ЭКГ но результат тот же, нет патологий.Сейчас я почти не ем боюсь новых приступов. Терапевт в гос поликлинике почти не выслушав с ходу назначила Панзинорм и Нексиум вот пью уже две недели без малейших изменений. Да два года принимаю по назначению кардиолога конкор 2.5. Помогите советом просто уже не знаю что делать постоянно добавляется что то новое к моим симптомам.
На сервисе СпросиВрача доступна консультация кардиолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Что такое экстрасистолия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Белоус А. В., кардиолога со стажем в 7 лет.
Определение болезни. Причины заболевания
Эта патология может быть как функционального, так и органического происхождения. Чаще всего экстрасистолы носят функциональный характер, то есть возникают в отсутствие серьёзного структурного поражения сердца.
Факторы, провоцирующие функциональные экстрасистолы:
Экстрасистолы органического происхождения могут возникать на фоне следующих состояний:
Экстрасистолия относится к числу самых безобидных аритмий, и сама по себе не влияет на продолжительность жизни, а зачастую не влияет и на самочувствие. Однако её безобидность относительна: хотя сама по себе экстрасистолия ничем не угрожает, но при наличии органического заболевания желудочковая экстрасистолия может привести к серьёзным осложнениям, прежде всего — к фатальным аритмиям.
Именно по этой причине желудочковая экстрасистолия более опасна чем предсердная или атриовентрикулярная экстрасистолия.
Симптомы экстрасистолии
Симптомы при экстрасистолии могут отсутствовать, особенно если она возникает на фоне органического заболевания сердца. Частые симптомы, которыми проявляется экстрасистолия:
Функциональные экстрасистолы могут возникать на фоне неврозов или при нарушении работы вегетативной нервной системы. При этом присутствует:
Патогенез экстрасистолии
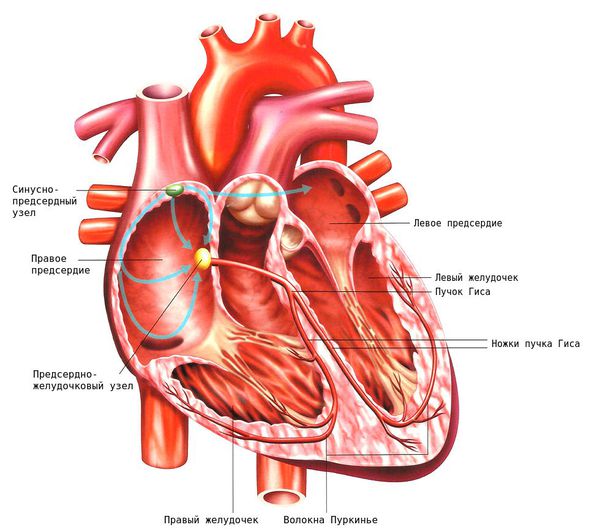
Проводящая система сердца — это комплекс специальных клеток, обеспечивающих возникновение и распространение электрического импульса по миокарду. Благодаря этому становится возможным последовательное, координированное сокращение миокарда. Проводящая система сердца представлена синусным узлом, атриовентрикулярным узлом (между предсердиями и желудочками), пучком Гиса с левой и правой ножкой, волокнами Пуркинье.
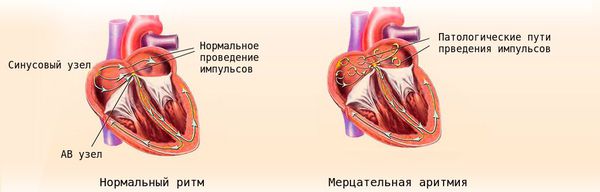
При развитии в отдельных участках миокарда патологических процессов электрические свойства этих участков миокарда и проводящей системы сердца могут существенно отличаться друг от друга. К таким патологическим процессам относятся ишемия, дистрофия, некроз, кардиосклероз, а также значительные метаболические нарушения. Возникает разная скорость проведения электрического импульса и развиваются однонаправленные блокады проведений и участки замедленного распространения электрических импульсов.
Возбуждение этого участка может повторно распространяться на рядом лежащие отделы сердца ещё до того, как к ним вновь подойдет очередной импульс из синоатриального узла. Возникает повторный вход волны возбуждения в те отделы сердца, которые только что вышли из состояния рефрактерности («нечувствительности»), в результате чего наступает преждевременное внеочередное возбуждение сердца — экстрасистола.
Другой механизм развития экстрасистол — патологический автоматизм, когда электрические импульсы зарождаются не там, где это предусмотрено нормальным ходом процесса.
Классификация и стадии развития экстрасистолии
Классификация экстрасистол по локализации:
Классификация экстрасистол по этиологическому фактору:
Классификация по количеству очагов экстрасистолических импульсов:
Классификация экстрасистол по количеству:
Классификация желудочковых экстрасистол по Лауну-Вольфу-Райяну по степени их негативного влияния на прогноз:
В международной классификации болезней утверждена следующая кодировка экстрасистолии:
Осложнения экстрасистолии
Наджелудочковая экстрасистолия не связана с повышенным риском внезапной смерти, однако в редких случаях она может стать причиной суправентрикулярной тахикардии — разновидности аритмии, приводящей к резкому и продолжительному увеличению частоты сердечных сокращений. Кроме того, у больных с пароксизмами фибрилляции предсердий именно предсердные экстрасистолы могут «запускать» эти пароксизмы фибрилляции — волны хаотического повторного возбуждения в предсердиях, опасные риском развития сердечной недостаточности[10].
Имеются отдельные публикации, где было показано, что желудочковые экстрасистолы могут свидетельствовать о повышении риска смерти в будущем. Эти случаи затрагивали экстрасистолии, возникающие при физических нагрузках, особенно на этапе восстановления [11].
На сократительной функции желудочков очень частые желудочковые экстрасистолы могут сказываться негативно, однако это возможно в основном при очень большом количестве экстрасистол — десятки тысяч. При значительном структурном поражении сердца желудочковые экстрасистолы могут косвенно указывать на повышенный риск внезапной сердечной смерти.
Диагностика экстрасистолии
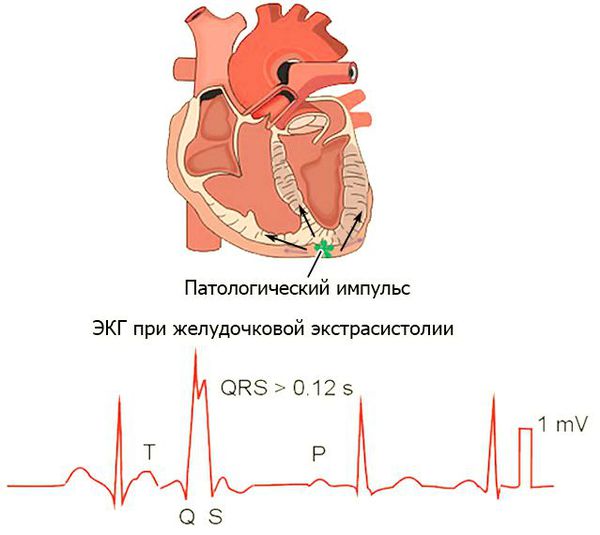
Заподозрить экстрасистолию можно при наличии жалоб пациента на перебои в работе сердца. Экстрасистолы распознаются при пальпации пульса, а также при выслушивании сердца фонендоскопом, однако определить источник экстрасистолии (суправентрикулярная или желудочковая) таким путем невозможно. Основной метод диагностики экстрасистолии — это электрокардиография и суточное мониторирование ЭКГ, т. е. запись электрических потенциалов сердца с поверхности тела [2].
Таким образом, диагностика экстрасистолии включает:
Велоэргометрия регистрирует ЭКГ и показатели артериального давления на фоне физической нагрузки и после её завершения. Во время диагностики пациент вращает педали специального тренажёра (велоэргометра) с возрастающей скоростью, либо идет по ленте движущейся дорожки (тредмил). Нагрузка при этом возрастает постепенно.
С помощью двух последних методов выявляют экстрасистолы, возникающие именно при физических нагрузках.
Также для уточнения диагноза могут потребоваться лабораторные исследования:
Лечение экстрасистолии
Лечение экстрасистолии может быть медикаментозным, либо хирургическим (радиочастотная аблация). Кроме того, врач пытается выявить причины экстрасистолии и воздействовать на них (этиотропное лечение). Далеко не всегда экстрасистолия вообще требует лечения.
Этиотропное лечение
Поиск причин и воздействие на них составляет основу данного подхода, который, однако, не всегда возможно реализовать. При экстрасистолии вегетативного происхождения показана консультация невролога или психотерапевта. Часто применяемые в таких ситуациях успокоительные растительные сборы (пустырник, валериана, мелисса, настойка пиона) не имеют серьёзной доказательной базы.
Психотропные препараты применяются либо тогда, когда есть отчётливая связь между психоэмоциональными нарушениями и экстрасистолией, либо (чаще), когда экстрасистолия усугубляет фоновую тревожность или депрессию. Это могут быть как транквилизаторы, так и антидепрессанты.
Если есть основания думать, что экстрасистолия вызвана приёмом лекарственных средств, например диуретиков, противоаритмических препаратов, бета-адреностимуляторов или антидепрессантов, то возможна их пробная отмена.
В случаях, когда экстрасистолия протекает бессимптомно или малосимптомно, её лечение обычно не требуется [3]. В том случае, если пациент субъективно плохо переносит экстрасистолию, а самих экстрасистол достаточно много (тысячи), возможна лекарственная терапия. Препарат выбирают в зависимости от вида экстрасистолии и частоты сокращений сердца. Экстрасистолия обычно хорошо поддаётся лечению антиаритмическими препаратами. В клинической практике применяют классификацию антиаритмических препаратов по E. Vaughan- Williams:
1. Класс I. Мембраностабилизирующие препараты, блокаторы натриевых каналов. Подразделяются на классы Ia, Ib и Ic.
Если экстрасистолы на фоне достаточно длительной терапии или их число многократно уменьшается, может быть предпринята пробная отмена лекарственного препарата. В части случаев экстрасистолия после этого не возобновляется.
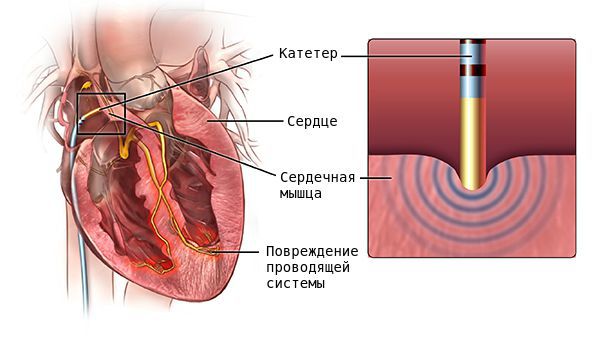
Хирургическое лечение
Прогноз. Профилактика
При серьёзном органическом поражении миокарда (например, при низкой сократимости левого желудочка после перенесенного инфаркта миокарда) существует риск развития тяжелых желудочковых нарушений сердечного ритма, способных привести к смерти. Это желудочковая тахикардия и фибрилляция желудочков. При отсутствии органического поражения сердца экстрасистолия существенно прогноз не отягощает.
Профилактика заключается в предотвращение тех заболеваний сердца, на фоне которых экстрасистолия часто развивается, а также тех воздействий, о которых известно их проаритмогенное влияние:
Также для профилактики следует:
ЭКСТРАСИСТОЛИЯ: клиническое значение, диагностика и лечение
Экстрасистолами называют преждевременные комплексы (преждевременные сокращения), выявляемые на ЭКГ. По механизму возникновения преждевременные комплексы подразделяются на экстрасистолы и парасистолы. Различия между экстрасистолией и парасистолией являютс
Экстрасистолами называют преждевременные комплексы (преждевременные сокращения), выявляемые на ЭКГ. По механизму возникновения преждевременные комплексы подразделяются на экстрасистолы и парасистолы. Различия между экстрасистолией и парасистолией являются чисто электрокардиографическими или электрофизиологическими. Клиническое значение и лечебные мероприятия при экстрасистолии и парасистолии абсолютно одинаковы. По локализации источника аритмии электросистолы разделяют на наджелудочковые и желудочковые.
Экстрасистолы, несомненно, являются самым распространенным нарушением ритма сердца. Они часто регистрируются и у здоровых лиц. При проведении суточного мониторирования ЭКГ статистической «нормой» экстрасистол считается примерно до 200 наджелудочковых экстрасистол и до 200 желудочковых экстрасистол в сутки. Экстрасистолы могут быть одиночными или парными. Три и более экстрасистолы подряд принято называть тахикардией («пробежки» тахикардии, «короткие эпизоды неустойчивой тахикардии»). Неустойчивой тахикардией называют эпизоды тахикардии продолжительностью менее 30 с. Иногда для обозначения 3–5 экстрасистол подряд используют определение «групповые», или «залповые», экстрасистолы. Очень частые экстрасистолы, особенно парные и рецидивирующие «пробежки» неустойчивой тахикардии, могут достигать степени непрерывно-рецидивирующей тахикардии, при которой от 50 до 90% сокращений в течение суток составляют эктопические комплексы, а синусовые сокращения регистрируются в виде единичных комплексов или коротких кратковременных эпизодов синусового ритма.
В практической работе и научных исследованиях основное внимание уделяют желудочковой экстрасистолии. Одной из наиболее известных классификаций желудочковых аритмий является классификация B. Lown и M. Wolf (1971).
Предполагалось, что высокие градации экстрасистол (классы 3–5) являются наиболее опасными. Однако в дальнейших исследованиях было установлено, что клиническое и прогностическое значение экстрасистолии (и парасистолии) практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) экстрасистолия, включая эпизоды неустойчивой желудочковой тахикардии и даже непрерывно-рецидивирующей тахикардии, не влияет на прогноз и не представляет опасности для жизни. Аритмии у лиц без признаков органического поражения сердца называют идиопатическими. У больных с органическим поражением миокарда (постинфарктный кардиосклероз, дилатация и/или гипертрофия левого желудочка) наличие экстрасистолии считается дополнительным прогностически неблагоприятным признаком. Но даже в этих случаях экстрасистолы не имеют самостоятельного прогностического значения, а являются отражением поражения миокарда и дисфункции левого желудочка.
В 1983 г J. T. Bigger предложил прогностическую классификацию желудочковых аритмий.
Однако, как было отмечено, независимого прогностического значения желудочковая экстрасистолия не имеет. Сами по себе экстрасистолы в большинстве случаев безопасны. Экстрасистолию даже называют «косметической» аритмией, подчеркивая этим ее безопасность. Даже «пробежки» неустойчивой желудочковой тахикардии тоже относят к «косметическим» аритмиям и называют «энтузиастическими выскальзывающими ритмами» (R. W. Campbell, K. Nimkhedar, 1990). В любом случае лечение экстрасистолии с помощью антиаритмических препаратов (ААП) не улучшает прогноз. В нескольких крупных контролируемых клинических исследованиях было выявлено заметное повышение общей смертности и частоты внезапной смерти (в 2–3 раза и более) у больных с органическим поражением сердца на фоне приема ААП класса I, несмотря на эффективное устранение экстрасистол и эпизодов желудочковой тахикардии. Наиболее известным исследованием, в котором впервые было выявлено несоответствие клинической эффективности препаратов и их влияния на прогноз, является исследование CAST. В исследовании CAST («исследование подавления аритмий сердца») у больных, перенесших инфаркт миокарда, на фоне эффективного устранения желудочковой экстрасистолии препаратами класса I С (флекаинид, энкаинид и морицизин) выявлено достоверное увеличение общей смертности в 2,5 раза и частоты внезапной смерти в 3,6 раза по сравнению с больными, принимавшими плацебо. Результаты исследования заставили пересмотреть тактику лечения не только пациентов с нарушениями ритма, но и кардиологических больных вообще. Исследование CAST является одним из основных в становлении «медицины, основанной на доказательствах». Только на фоне приема β- адреноблокаторов и амиодарона отмечено снижение смертности больных с постинфарктным кардиосклерозом, сердечной недостаточностью или реанимированных пациентов. Однако положительное влияние амиодарона и особенно β-адреноблокаторов не зависело от антиаритмического действия этих препаратов.
Выявление экстрасистолии (как и любого другого варианта нарушений ритма) является поводом для обследования, направленного прежде всего на выявление возможной причины аритмии, заболевания сердца или экстракардиальной патологии и определения функционального состояния миокарда.
ААП не излечивают от аритмии, а только устраняют ее на период приема препаратов. При этом побочные реакции и осложнения, связанные с приемом практически всех препаратов, могут быть гораздо более неприятными и опасными, чем экстрасистолия. Таким образом, само по себе наличие экстрасистолии (независимо от частоты и «градации») не является показанием для назначения ААП. Бессимптомные или малосимптомные экстрасистолы не требуют проведения специального лечения. Таким больным показано диспансерное наблюдение с проведением эхокардиографии примерно 2 раза в год для выявления возможных структурных изменений и ухудшения функционального состояния левого желудочка. Л. М. Макаров и О. В. Горлицкая (2003) при длительном наблюдении за 540 больными с идиопатической частой экстрасистолией (более 350 экстрасистол в час и более 5000 в сутки) выявили у 20% больных увеличение полостей сердца («аритмогенная кардиомиопатия»). Причем более часто увеличение полостей сердца отмечалось при наличии предсердной экстрасистолии.
Показания для лечения экстрасистолии:
Лечение экстрасистолии
Необходимо объяснить больному, что малосимптомная экстрасистолия безопасна, а прием антиаритмических препаратов может сопровождаться неприятными побочными эффектами или даже вызвать опасные осложнения. Прежде всего необходимо устранить все потенциально аритмогенные факторы: алкоголь, курение, крепкий чай, кофе, прием симпатомиметических препаратов, психоэмоциональное напряжение. Следует немедленно приступить к соблюдению всех правил здорового образа жизни.
При наличии показаний для назначения ААП у больных с органическим поражением сердца используют β-адреноблокаторы, амиодарон и соталол. У больных без признаков органического поражения сердца, кроме этих препаратов, применяют ААП класса I: Этацизин, Аллапинин, Пропафенон, Кинидин Дурулес. Этацизин назначают по 50 мг 3 раза в день, Аллапинин — по 25 мг 3 раза в день, Пропафенон — по 150 мг 3 раза в день, Кинидин Дурулес — по 200 мг 2–3 раза в день.
Лечение экстрасистолии проводят методом проб и ошибок, последовательно (по 3–4 дня) оценивая эффект приема антиаритмических препаратов в средних суточных дозах (с учетом противопоказаний), выбирая наиболее подходящий для данного больного. Для оценки антиаритмического эффекта амиодарона может потребоваться несколько недель или даже месяцев (применение более высоких доз амиодарона, например по 1200 мг/сут, может сократить этот период до нескольких дней).
Эффективность амиодарона в подавлении желудочковых экстрасистол составляет 90–95%, соталола — 75%, препаратов класса I C — от 75 до 80% (B. N. Singh, 1993).
Критерий эффективности ААП — исчезновение ощущения перебоев, улучшение самочувствия. Многие кардиологи предпочитают начинать подбор препаратов с назначения β-адреноблокаторов. У больных с органическим поражением сердца при отсутствии эффекта от β-адреноблокаторов применяют Амиодарон, в том числе в комбинации с первыми. У больных с экстрасистолией на фоне брадикардии подбор лечения начинают с назначения препаратов, ускоряющих ЧСС: можно попробовать прием пиндолола (Вискен), эуфиллина (Теопек) или препаратов класса I (Этацизин, Аллапинин, Кинидин Дурулес). Назначение холинолитических препаратов типа белладонны или симпатомиметиков менее эффективно и сопровождается многочисленными побочными явлениями.
В случае неэффективности монотерапии оценивают эффект комбинаций различных ААП в уменьшенных дозах. Особенно популярны комбинации ААП с β-адреноблокаторами или амиодароном.
Есть данные, что одновременное назначение β-адреноблокаторов (и амиодарона) нейтрализует повышенный риск от приема любых антиаритмических средств. В исследовании CAST у больных, перенесших инфаркт миокарда, которые наряду с препаратами класса I C принимали β-адреноблокаторы не было отмечено увеличения смертности. Более того, было выявлено снижение частоты аритмической смерти на 33%!
Особенно эффективна комбинация β-адреноблокаторов и амиодарона. На фоне приема такой комбинации наблюдалось еще большее снижение смертности, чем от каждого препарата в отдельности. Если ЧСС превышает 70–80 уд./мин в покое и интервал P–Q в пределах 0,2 с, то проблемы с одновременным назначением амиодарона и β-адреноблокаторов нет. В случае брадикардии или АВ-блокады I–II степени для назначения амиодарона, β-адреноблокаторов и их комбинации необходима имплантация кардиостимулятора, функционирующего в режиме DDD (DDDR). Есть сообщения о повышении эффективности антиаритмической терапии при сочетании ААП с ингибиторами АПФ, блокаторами рецепторов ангиотензина, статинами и препаратами омега-3-ненасыщенных жирных кислот.
Некоторые противоречия существуют в отношении применения амиодарона. С одной стороны, некоторые кардиологи назначают амиодарон в последнюю очередь — только при отсутствии эффекта от других препаратов (считая, что амиодарон довольно часто вызывает побочные явления и требует длительного «периода насыщения»). С другой стороны, возможно, более рационально начинать подбор терапии именно с амиодарона как наиболее эффективного и удобного для приема препарата. Амиодарон в малых поддерживающих дозах (100–200 мг в день) редко вызывает серьезные побочные явления или осложнения и является скорее даже более безопасным и лучше переносимым, чем большинство других антиаритмических препаратов. В любом случае при наличии органического поражения сердца выбор небольшой: β-адреноблокаторы, амиодарон или соталол. При отсутствии эффекта от приема амиодарона (после «периода насыщения» — как минимум по 600–1000 мг/сут в течение 10 дней) можно продолжить его прием в поддерживающей дозе — 0,2 г/сут и, при необходимости, оценить эффект последовательного добавления препаратов класса I С (Этацизин, Пропафенон, Аллапинин) в половинных дозах.
У больных с сердечной недостаточностью заметное уменьшение количества экстрасистол может отмечаться на фоне приема ингибиторов АПФ и Верошпирона.
Следует отметить, что проведение суточного мониторирования ЭКГ для оценки эффективности антиаритмической терапии утратило свое значение, так как степень подавления экстрасистол не влияет на прогноз. В исследовании CAST выраженное увеличение смертности отмечено на фоне достижения всех критериев полного антиаритмического эффекта: уменьшения общего количества экстрасистол более чем на 50%, парных экстрасистол — не менее чем на 90% и полное устранение эпизодов желудочковой тахикардии. Основным критерием эффективности лечения является улучшение самочувствия. Это обычно совпадает с уменьшением количества экстрасистол, а определение степени подавления экстрасистолии не имеет значения.
В целом последовательность подбора ААП у больных с органическим заболеванием сердца, при лечении рецидивирующих аритмий, включая экстрасистолию, можно представить в следующем виде.
У больных без признаков органического поражения сердца можно использовать любые препараты, в любой последовательности или использовать схему, предложенную для больных с органическим заболеванием сердца.
Краткая характеристика ААП
β-адреноблокаторы. После исследования CAST и опубликования результатов метаанализа исследований по применению ААП класса I, в котором было показано, что практически все ААП класса I способны увеличивать смертность у больных с органическим поражением сердца, β-адреноблокаторы стали самыми популярными антиаритмическими препаратами.
Антиаритмический эффект β-адреноблокаторов обусловлен именно блокадой β-адренергических рецепторов, т. е. уменьшением симпатико-адреналовых влияний на сердце. Поэтому β-адреноблокаторы наиболее эффективны при аритмиях, связанных с симпатико-адреналовыми влияниями — так называемые «катехоламинзависимые» или «адренергические аритмии». Возникновение таких аритмий, как правило, связано с физической нагрузкой или психоэмоциональным напряжением.
Катехоламинзависимые аритмии в большинстве случаев одновременно являются «тахизависимыми», т. е. возникают при достижении определенной критической частоты сердечных сокращений, например во время физической нагрузки частая желудочковая экстрасистолия или желудочковая тахикардия возникают только при достижении частоты синусового ритма 130 сокращений в минуту. На фоне приема достаточной дозы β-адреноблокаторов больной не сможет достичь частоты 130 уд./мин при любом уровне физической нагрузки, таким образом предотвращается возникновение желудочковых аритмий.
β-адреноблокаторы являются препаратами выбора для лечения аритмий при врожденных синдромах удлинения интервала Q–T.
При аритмиях, не связанных с активацией симпатической нервной системы β-адреноблокаторы гораздо менее эффективны, но добавление β-адреноблокаторов нередко значительно увеличивает эффективность других антиаритмических препаратов и снижает риск аритмогенного эффекта ААП класса I. Препараты класса I в сочетании с β-адреноблокаторами не увеличивают смертность у больных с им поражением сердца (исследование CAST).
При так называемых «вагусных» аритмиях β-адреноблокаторы оказывают аритмогенное действие. «Вагусные» аритмии возникают в состоянии покоя, после еды, во время сна, на фоне урежения ЧСС («брадизависимые» аритмии). Вместе с тем в некоторых случаях при брадизависимых аритмиях эффективно применение пиндолола (Вискен) — β-адреноблокатора с внутренней симпатомиметической активностью (ВСА). Кроме пиндолола к β-адреноблокаторам с ВСА относятся окспренолол (Тразикор) и ацебутолол (Сектраль), однако в максимальной степени внутренняя симпатомиметическая активность выражена именно у пиндолола.
Дозы β-адреноблокаторов регулируют в соответствии с антиаритмическим эффектом. Дополнительным критерием достаточной β-блокады является снижение ЧСС до 50 уд./мин в состоянии покоя. В прежние годы, когда основным β-адреноблокатором был пропранолол (Анаприлин, Обзидан), известны случаи эффективного применения пропранолола при желудочковых аритмиях в дозах до 960 мг/сут и более, например до 4 г в день! (R. L. Woosley et al., 1979).
Амиодарон. Амиодарон таблетки 0,2 г. (оригинальным препаратом является Кордарон) обладает свойствами всех четырех классов ААП и, кроме того, оказывает умеренное a-блокирующее действие. Амиодарон, несомненно, является самым эффективным из существующих антиаритмических препаратов. Его даже называют «аритмолитическим препаратом».
Основным недостатком амиодарона является высокая частота экстракардиальных побочных эффектов, которые при длительном приеме наблюдаются у 10–75% больных. Однако необходимость в отмене амиодарона возникает у 5–25% (J. A. Johus et al., 1984; J. F. Best et al., 1986; W. M. Smith et al., 1986). К основным побочным эффектам амиодарона относятся: фотосенсибилизация, изменение цвета кожи, нарушение функции щитовидной железы (как гипотиреоз, так и гипертиреоз), повышение активности печеночных трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения. Большинство этих побочных эффектов обратимы и исчезают после отмены или при уменьшении дозы амиодарона. Гипотиреоз можно контролировать с помощью приема левотироксина. Наиболее опасным побочным эффектом амиодарона является поражение легких («амиодароновое поражение легких») — возникновение интерстициального пневмонита или, реже, легочного фиброза. У большинства больных поражение легких развивается только при длительном приеме сравнительно больших поддерживающих доз амиодарона — более 400 мг/сут. Такие дозы крайне редко применяют в России. Поддерживающая доза амиодарона в России обычно составляет 200 мг/сут или даже меньше (по 200 мг в день 5 дней в неделю). B. Clarke и соавторы (1985) сообщают лишь о трех случаях из 48 наблюдений возникновения этого осложнения на фоне приема амиодарона в дозе 200 мг в сутки.
В настоящее время изучается эффективность дронедарона, деривата амиодарона без йода. Предварительные данные свидетельствуют об отсутствии экстракардиальных побочных эффектов у дронедарона.
Соталол. Соталол (Соталекс, Сотагексал) таблетки 160 мг применяется в средней суточной дозе 240–320 мг. Начинают с назначения 80 мг 2 раза в день. При рефрактерных аритмиях иногда используют прием соталола до 640 мг/сут. β-адреноблокирующее действие соталола проявляется начиная с дозы 25 мг.
На фоне приема соталола имеется повышенный риск развития желудочковой тахикардии типа «пируэт». Поэтому прием соталола желательно начинать в стационаре. При назначении соталола необходимо тщательно контролировать величину интервала Q–T, особенно в первые 3 дня. Корригированный интервал Q–T не должен превышать 0,5 с. В этих случаях риск развития тахикардии типа «пируэт» менее 2%. С увеличением дозы соталола и степени удлинения интервала Q–T значительно увеличивается риск развития тахикардии типа «пируэт». Если корригированный интервал Q–T превышает 0,55 с — риск тахикардии типа «пируэт» достигает 11%. Поэтому при удлинении интервала Q–T до 0,5 с необходимо уменьшить дозу соталола или отменить препарат.
Побочные эффекты соталола соответствуют типичным побочным эффектам β-адреноблокаторов.
Этацизин. Этацизин таблетки 50 мг. Наиболее изученный отечественный препарат (создан в СССР). Для лечения аритмий применяется с 1982 г. Быстрое достижение клинического эффекта позволяет с успехом использовать Этацизин у лиц без органического поражения сердца для лечения желудочковых и наджелудочковых нарушений ритма: экстрасистолии, всех вариантов пароксизмальных и хронических тахиаритмий, в том числе мерцательной аритмии, при синдроме Вольфа–Паркинсона–Уайта. Наиболее эффективен Этацизин у пациентов с ночными аритмиями, а также при желудочковой экстрасистолии.Средняя суточная доза Этацизина составляет 150 мг (по 50 мг 3 раза в день). Максимальная суточная доза — 250 мг. При назначении этацизина для предупреждения рецидивирования мерцательной аритмии, наджелудочковых и желудочковых тахикардий его эффективность, как правило, превосходит эффективность других АПП класса I. Препарат хорошо переносится, необходимость в отмене возникает примерно у 4% больных. Основные побочные эффекты: головокружение, головная боль, «онемение» языка, нарушение фиксации взора. Обычно побочные реакции наблюдаются сравнительно редко, и их выраженность уменьшается после первой недели приема Этацизина.
Аллапинин. Отечественный препарат Аллапинин, таблетки 25 мг (создан также в СССР) применяется в клинической практике с 1986 г. Назначают по 25–50 мг 3 раза в день. Максимальная суточная доза составляет 300 мг. Аллапинин довольно эффективен при наджелудочковых и желудочковых аритмиях. Основные побочные явления — головокружение, головная боль, нарушение фиксации взора. Необходимость в отмене возникает примерно у 6% больных. Одной из особенностей аллапинина и теоретически его недостатком является наличие β-адреностимулирующего действия.
Пропафенон (Ритмонорм, Пропанорм), таблетки 150 мг, ампулы 10 мл (35 мг). Назначают по 150–300 мг 3 раза в день. При необходимости дозу увеличивают до 1200 мг/сут. Пропафенон, кроме замедления проведения, слегка удлиняет рефрактерные периоды во всех отделах сердца. Кроме того, пропафенон обладает небольшим β-адреноблокирующим действием и свойствами антагонистов кальция.
К основным побочным эффектам пропафенона относятся головокружение, нарушение фиксации взора, атаксия, тошнота, металлический вкус во рту.
Хинидин. В настоящее время в России используют в основном Кинидин Дурулес, табл. по 0,2 г. Разовая доза составляет 0,2–0,4 г, средняя суточная доза — от 0,6 до 1,0 г. Максимальная суточная доза хинидина в прежние годы (когда хинидин был основным антиаритмическим препаратом) достигала 4,0 г! В настоящее время такие дозы не используются и примерной максимальной суточной дозой хинидина можно считать 1,6 г.
В небольших дозах (600–800 мг/сут) хинидин хорошо переносится. Побочные явления возникают обычно при более высоких дозах. К наиболее частым побочным эффектам при приеме хинидина относятся нарушения функции желудочно-кишечного тракта: тошнота, рвота, понос. Реже отмечаются головная боль, головокружения, ортостатическая гипотония. Самое опасное осложнение от приема хинидина — возникновение желудочковой тахикардии типа «пируэт». По данным литературы, это осложнение наблюдается у 1–3% больных, принимающих хинидин.
П. Х. Джанашия, доктор медицинских наук, профессор
С. В. Шлык, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
РГМУ, Москва