Супрессоры что это такое в медицине
Супрессоры что это такое в медицине
Т супрессоры.
Чужеродные Аг в неиммуногенной форме (гаптены) или иммуногенные Аг в очень высокой концентрации также способны индуцировать специфическую супрессорную активность клеток. После распознавания Аг зрелые лимфоциты препятствуют развитию иммунного ответа, действуя непосредственно на клетки или секретируя супрессорные факторы.
Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров.
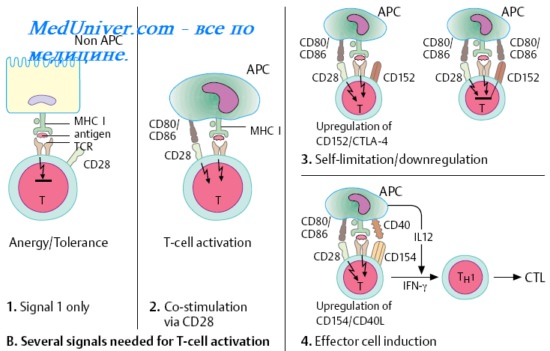
Цитотоксические Т-лимфоциты (ЦТЛ), или Т-киллеры [от англ. to kill, убивать] лизируют клетки-мишени, несущие чужеродные или видоизменённые аутоантигены (например, клетки опухолей, трансплантатов, инфицированные вирусами, клетки, несущие поверхностные вирусные Аг). В большинстве случаев функция ЦТЛ также МНС-рестригирована — цитотоксические Т-лимфоциты распознаёт чужеродный вирусный, опухолевый или трансплантационный Аг в комплексе с молекулой МНС I на мембране клетки-мишени. Индукция цитотоксических свойств клетки-предшественницы Т-киллера происходит под действием двух сигналов.
Первый сигнал включает взаимодействие между двумя комплексами: поверхностной молекулой CD8 лимфоцита и комплексом эпитоп-молекула МНС I на клетке-мишени. Второй сигнал — ИЛ, секретируемые близлежащими макрофагами и Т-клетками. Т-хелпер играет ключевую роль в стимуляции цитотоксических Т-лимфоцитов в качестве источника необходимых цитокинов, усиливающих их пролиферацию и созревание до функционально активных ЦТЛ.
Цитотоксический эффект Т-киллеров реализуется через образование в клетках-мишенях пор под действием особых белков — перфоринов. Нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки.
Т-клетки памяти
Т-клетки памяти образуются при первичном иммунном ответе. Специфически распознают Аг и участвуют в иммунном ответе при вторичном попадании Аг. Большинство клеток памяти обладает функциями Т-клеток, экспрессируют CD4 и рестригированы по молекулам МНС II, то есть узнают Аг только на Аг-представляющих клетках в связи с молекулой МНС II.
Клетки T-reg как иммунные регуляторы
Клетки T-reg как иммунные регуляторы
Регуляторные Т-клетки, существование которых было доказано совсем недавно, удерживают защитные силы организма от нападения на него самого. Манипуляции с этими клетками могут предложить новые методы лечения различных заболеваний, начиная от диабета и заканчивая отторжением органов.
Про клетки Тreg см. также:
«Тяжелейший аутотоксикоз» — такой термин был введен около ста лет назад известным немецким врачом-бактериологом Паулем Эрлихом для описания патологического состояния, при котором иммунная система человека «атакует» его же собственные органы и ткани. Эрлих полагал, что с биологической точки зрения в аутоиммунности (еще одно введенное им определение) нет ничего абсурдного, когда она находится под строжайшим контролем. Однако медицинское сообщество не приняло столь неоднозначной идеи. В самом деле, зачем природе встраивать в организм человека механизм, способный разрушать своего носителя?
Ненадежная система обороны
Многих людей сегодня пугает сознание того, что иммунная система в любой момент может выйти из-под контроля и спровоцировать аутоиммунное заболевание. Неприятнее всего то, что такой «иммунологический дамоклов меч» не так уж трудно привести в действие. Например, при введении мышам белков их собственной центральной нервной системы вместе с каким-нибудь адъювантом (неспецифическим стимулятором иммуногенеза) возникает деструктивная иммунная реакция, которая в основном проявляется как рассеянный склероз, вызывающий разрушение головного и спинного мозга.
Вводя животным их собственные белки разного происхождения, можно вызвать и другие аутоиммунные реакции. Такая же опасность подстерегает и человека. По крайней мере, из крови вполне здоровых людей выделены аутореактивные клетки иммунной системы, которые в пробирке ведут себя крайне агрессивно в отношении тканей своего родного организма.
Почему же при наличии постоянной угрозы со стороны собственной иммунной системы большинство из нас не страдает аутоиммунными заболеваниями? Каким образом наша внутренняя защита отличает опасных микробов от нормальных клеток своего организма? Исследователи обнаружили, что для обеспечения самотолерантности (способности удерживать иммунную систему в рамках) принимается множество мер предосторожности. Первая линия обороны, во всяком случае, в том, что касается Т-клеток, располагается в тимусе. Здесь созревшие Т-клетки проходят серьезный «курс обучения» и настраиваются на крайне слабую реакцию на здоровые клетки организма-хозяина. Клетки, не поддающиеся «дрессировке», отбраковываются. Однако ни одна система не застрахована от ошибок, и некоторое количество аутоагресивных Т-клеток ускользает от контроля. Попадая в кровоток и лимфу, они создают угрозу запуска аутоиммунной реакции.
Кровь и лимфа представляют собой вторую линию обороны. Здесь используется несколько приемов. Некоторые ткани, в том числе головного и спинного мозга, ограждены от аутоагрессивных клеток иммунной системы тем, что к ним ведет небольшое число сосудов, уходящих вглубь этих органов. Однако такая самоизоляция не может быть полной. В силу определенных обстоятельств (например, при повреждении тканей) аутореактивные клетки все же могут проникнуть внутрь. Другие способы защиты носят упреждающий характер. Иммунные клетки, проявляющие подозрительный интерес к здоровым тканям и органам, атакуются другими компонентами иммунной системы и разрушаются или инактивируются ими.
По-видимому, среди «подразделений», участвующим в упреждающих действиях, ключевая роль принадлежит регуляторным Т-клеткам. Большинство из них (а возможно, и все) обучаются мастерству в тимусе, а затем распространяются по всему организму в виде специализированной субпопуляции Т-клеток.
История открытия регуляторных Т-клеток
В 1969 г. Ясуаки Нисидзука (Yasuaki Nishizuka) и Тэруе Сакакура (Teruyo Sakakura) из японского Центра по исследованию рака в г. Нагоя обнаружили, что удаление тимуса у новорожденных мышат женского пола приводит к серьезным последствиям — разрушению яичников. Вначале ученые предположили, что тимус секретирует гормоны, необходимые для развития и сохранения данных органов. Однако позже выяснилось, что ткани яичников у мышат, лишенных тимуса, буквально наводнены иммунными клетками, что свидетельствовало о наличии аутоиммунного заболевания, возникшего в результате выхода из строя какого-то регуляторного механизма. Стоило ввести грызунам нормальные Т-клетки, как болезнь отступала. Все указывало на то, что в популяции Т-клеток имеется система самоконтроля.

Обзор: иммунные регуляторы
Как работают T-reg-клетки?
Механизм подавления аутоиммунной активности клетками T-reg остается загадкой. По-видимому, они способны воздействовать на самые разные клети иммунной системы, блокируя их амплификацию и такие процессы, как секреция сигнальных молекул — цитокинов. Специалисты склонны думать также, что T-reg-клетки активируются прямым межклеточным взаимодействием. Во всем остальном картина остается неясной.
Рис.1. Механизм самотолерантности
Имеются ли какие-либо данные о том, что человеку также необходимы T-reg-клетки? И есть ли они в нашем организме? Исследователи выяснили, что молекулярные особенности, характерные для T-reg-грызунов, присущи также некой субпопуляции Т-клеток человека. На поверхности данных клеток присутствуют молекулы CD25, а внутри содержится необычайно много белка Foxp3. Они обладают иммуносупрессивными свойствами — по крайней мере, таковы результаты опытов in vitro.
Рис. 2. Как T-reg-клетки подавляют аутоиммунную реакцию
Не только самотолерантность
Итак, есть указания на то, что T-reg-клетки действительно предотвращают развитие аутоиммунных заболеваний у человека, однако их роль оказалась еще значительнее. Так, они принимают участие в реакции организма на проникновение микробов.
В 1990-х гг. Фиона Паури (Fiona Powrie) из DNAX, исследовательского института в Пало-Альто, шт. Калифорния, проводила эксперименты по введению популяции Т-клеток, обедненной T-reg, мышам с нефункционирующей иммунной системой. В одной из серий экспериментов у животных развилось острое воспаление кишечника. Но аберрантная иммунная реакция была направлена в первую очередь не на клетки самого органа.
В кишечнике как грызунов, так и человека присутствует множество микроорганизмов. Нередко их число превышает триллион на каждый грамм ткани. Большинство из них не только безвредны, но даже необходимы: они улучшают пищеварение и вытесняют патогенные бактерии (например, сальмонеллы), которые в противном случае заселили бы кишечник. В норме иммунная система никак не реагирует на присутствие полезных, хотя и чужеродных тел. Но у мышей, которые использовала в своих опытах Паури, все было не так. Введенные иммунные клетки атаковали не только микроорганизмы, но и стенки кишечника реципиента. Однако при инъекции клеток T-reg подобных проблем не возникало. И если бы последние вводились вместе с другими Т-клетками с самого начала, то никакого воспалительного процесса в кишечнике не возникло бы. Подводя итоги, можно сказать, что иммунная система представляет собой спусковой механизм, готовый в любую минуту атаковать микрофлору кишечника, и сдерживают ее только T-reg-клетки.
Ответ иммунной системы на болезнетворные чужеродные агенты может контролироваться аналогичным образом. С одной стороны, T-reg-клетки способны блокировать слишком сильную реакцию, с другой — предотвращать уничтожение какого-нибудь инородного тела, позволяя ему существовать в организме хозяина. Есть свидетельство того, например, что невозможность полностью уничтожить обитающую в желудке бактерию Helicobactor pilori, вызывающую язвенную болезнь, связана с «умиротворяющим» действием T-reg-клеток на иммунную систему.
Рис. 3. T-reg сама подавляет активность других T-клеток
Есть указания и на то, что клетки T-reg способствуют нормальному (с иммунологической точки зрения) протеканию беременности, которая всегда оказывается вызовом иммунной системе. Поскольку плод наследует от матери только половину генов, а вторую получает от отца, он генетически не идентичен матери и по существу может считаться имплантированным органом. От отторжения плод защищает целый ряд механизмов, функционирующих в трофобласте (плацентарной ткани, соединяющей зародыш со стенкой матки). Трофобласт — не просто физиологический барьер для содержащихся в материнской крови веществ, вредных для плода: в нем продуцируются молекулы-иммуносупрессанты.
При беременности иммунная система будущей матери претерпевает изменения. Есть данные, что у женщин с таким аутоиммунным заболеванием, как рассеянный склероз, в период беременности T-reg-клетки проявляют большую активность. Недавно получены дополнительные данные: Александр Бетц (Alexander Betz) из Кембриджского университета обнаружил, что у беременных мышей повышено число материнских клеток T-reg. Причем у генетически модифицированных особей, не имеющих T-reg, при вынашивании потомства наблюдается массовое проникновение иммунных клеток через плацентарный барьер. Есть основания полагать, что причиной спонтанных абортов у некоторых женщин оказывается низкая активность T-reg-клеток.
Использование T-reg-клеток в медицине
Итак, T-reg-клетки являются мощным природным регулятором иммунной системы. Научившись влиять на его работу, мы сможем лечить различные заболевания. Ожидать немедленного практического внедрения подобного способа борьбы с недугами, конечно, не приходится, но имеющиеся данные позволяют надеяться, что введение в организм самих T-reg-клеток или препаратов, воздействующих на их активность, уже в скором времени сможет облегчить состояние некоторых больных.
Речь идет, прежде всего, об аутоиммунных заболеваниях. Возможно, с помощью T-reg-клеток удастся справиться также с разными видами аллергии. А легкость, с которой клетки T-reg «усмиряют» иммунную систему, предполагает, что они могут стать незаменимыми при операциях по пересадке органов.
Альтернативный метод мог бы состоять в избирательном устранении определенных компонентов из популяции T-reg-клеток для подавления нежелательной иммуносупресии и, следовательно, для усиления реакции, направленной на нужную мишень. Оптимальным было бы удаление только тех T-reg-клеток, которые блокируют специфическую иммунную реакцию. Такая стратегия может быть незаменима в борьбе с инфекционными заболеваниями, при которых иммунная система, предоставленная самой себе, часто действует не совсем адекватно, например, при туберкулезе и СПИДе.
Рис.4. Будущее трансплантологии
Технические трудности
До сих пор не было никаких попыток создать препараты, увеличивающие или уменьшающие численность популяции T-reg-клеток непосредственно в организме человека. Любые средства, которые можно было бы использовать, должны обладать способностью влиять только на те субпопуляции T-reg-клеток, которые играют роль в развитии конкретного заболевания. Но как распознать такие клетки, специалисты пока не знают.
Библиотека
Опухолевые супрессоры и мутаторные гены
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
3.3.1. Типы опухолей, ассоциированные с аномалиями р53
Герминальные (произошедшие в половой клетке и передающиеся по наследству) мутации в одном из аллелей гена р53 вызывают синдром Ли-Фраумени, заключающийся во врожденном предрасположении к развитию различных новообразований, в первую очередь сарком, рака молочной железы, лимфолейкозов. Нередко синдром Ли-Фраумени характеризуется возникновением первично-множественных опухолей. Примечательно, что у трансгенных мышей, несущих инактивирующие мутации в гене р53, наблюдается картина, очень напоминающая синдром Ли-Фраумени. Примерно у трети животных, у которых инактивирован один из двух аллелей р53, в течение 6-9 месяцев после рождения возникают новообразования, причем их спектр очень сходен с наблюдаемым при синдроме Ли-Фраумени. При этом в части этих опухолей, как и новообразований у пациентов с синдромом Ли-Фраумени, сохраняется экспрессия неповрежденного аллеля гена р53. При врожденной инактивации во всех клетках организма обоих аллелей гена р53 опухоли развиваются практически у всех животных. Примерно такая же картина наблюдается у трансгенных мышей, несущих дополнительный экзогенный аллель р53, кодирующий белок с миссенс-мутацией.
3.3.2. Структурная организация и биохимические активности белка р53
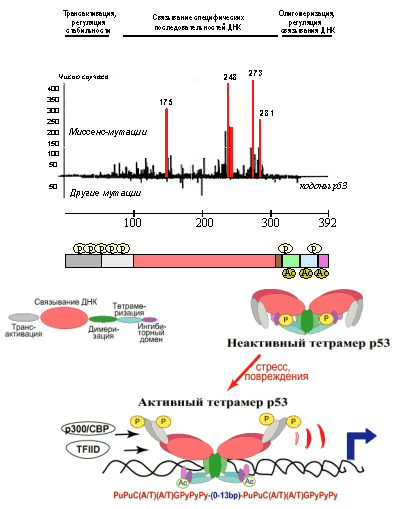
Продукт гена р53 имеет мол. массу 53кДа и состоит из 392 аминокислотных остатков. Он образует тетрамерный комплекс, способный регулировать транскрипцию ряда генов, имеющих в своем составе специфические последовательности ДНК, так называемые р53-респонсивные элементы. В молекуле р53 картировано несколько функционально-значимых доменов, играющих важную роль в осуществлении или регуляции его активности (Рис. 2).
N-концевой участок (аминокислоты 1-42) представляет собой домен, ответственный за транскрипционную активацию генов-мишеней. Он обладает способностью связываться с компонентами базальных факторов транскрипции, в частности с субъединицами hTAFII31, hTAF70 комплекса TFIID РНК-полимеразы II, а также с транскрипционным кофактором p300/CBP. Кроме того, этот домен участвует в белок-белковых взаимодействиях, регулирующих стабильность молекулы р53. И, наконец, в нем расположено несколько остатков серина и треонина, фосфорилирование которых регулирует активность р53.
Рис. 2. Схематическое изображение функциональных доменов р53, предполагаемой модели приобретения белком транскрипционно активной конформации и частоты встречаемости в новообразованиях человека мутаций в разных участках молекулы р53.
Далее идут участки ответственные за ядерную локализацию (аминокислоты 305-323) и димеризацию/тетрамеризацию молекул р53 (аминокислоты 323-356). С-концевой участок р53 (аминокислоты 363-392) представляет собой так называемый ингибиторный домен. В немодифицированном состоянии он препятствует посадке ДНК-связывающего домена на специфическую последовательность регулируемого гена. Фосфорилирование и ацетилирование его определенных сайтов вызывают изменения конформации белковой молекулы и переход тетрамеров р53 из неактивного (латентного) состояния в активное. В результате ДНК-связывающие домены освобождаются от блокирующего влияния ингибиторных доменов и приобретают способность садиться на р53-респонсивные элементы. Таким образом, к респонсивным генам привлекаются базовые факторы транскрипции, связывающиеся с N-концевым участком р53, и стимулируется синтез РНК генов-мишеней.
Помимо повышения транскрипции генов, содержащих специфические респонсивные элементы, белок р53 обладает также и рядом других активностей. В частности, он способен подавлять транскрипцию многих других генов, например протоонкогенов BCL2, JUN и FOS, гена фибронектина и т.д. В основе такой транс-репрессии лежит несколько механизмов: связывание и секвестрация активированным р53 ряда базовых факторов транскрипции (p300/CBP, TBP, CBF); способность связывать и рекрутировать к определенным генам гистоновые деацетилазы (HDAC), ремоделирующие хроматин; и т.д. Кроме того, р53 связывается с белками, вовлеченными в репликацию или репарацию ДНК и, как следствие, модулирует эти процессы. Так, взаимодействуя с белком RP-A, он ингибирует его способность активировать ДНК-полимеразы a и d, результатом чего является подавление репликации ДНК. Связывая компоненты комплекса TFIIH (ERCC2, ERCC3 и др.), р53 активирует его функцию и стимулирует тем самым эксцизионную репарацию ДНК. Связывание р53 с белком Rad51 ведет к стимуляции рекомбинаций ДНК и повышению эффективности репарацию двунитевых разрывов ДНК. На участие р53 в репарации ДНК указывает также и его способность проявлять активность 3′-5′-экзонуклеазы и узнавать участки одноцепочечной ДНК и/или неспаренные основания.
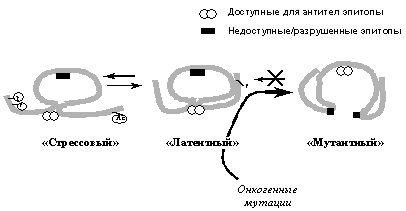
Рис. 3. Схематическое изображение различных конформационных состояний р53, распознаваемых специфическими антителами. Онкогенные мутации вызывают необратимый переход молекулы в денатурированное состояние, при котором открывается ранее недоступный эпитоп и, наоборот, исчезают некоторые ранее доступные эпитопы.
Характерные для опухолевых клеток миссенс-мутации приводят к резкому изменению конформации молекулы белка р53 (Рис. 3), что в значительной степени затрагивает все из вышеуказанных его активностей: происходит потеря или ослабление способности связывать и активировать гены с р53-респонсивными элементами, репрессировать другие специфические гены-мишени, ингибировать репликацию ДНК и стимулировать репарацию ДНК. Причем, так как р53 образует тетрамерные комплексы, мутации в одном аллеле гена р53 вызывают инактивацию и продукта второго, неповрежденного аллеля. Дело в том, что коэкспрессирующиеся нормальный и мутантный белок р53 образуют неактивные гетеромерные комплексы. Таким образом, мутантный белок ингибирует функции нормального белка р53 по доминантно-негативному механизму. По-видимому, именно эта особенность мутантных р53 в значительной мере ответственна за их онкогенный потенциал. В пользу этого свидетельствует тот факт, что введение в клетки короткого полипептида, соответствующего олигомеризационному домену р53, нарушает образование полноценных тетрамерных комплексов р53 и вызывает опухолевую трансформацию. Необходимо заметить, что помимо утраты нормальных функций р53, мутантные р53 с аминокислотными заменами в горячих точках (кодоны 175, 248 и др.) приобретают новые свойства, не свойственные белку р53 дикого типа (gain-of-function). Так, описано приобретение мутантными р53 способности активировать промоторы протоонкогенов MYC и ERB1, антиапоптотического гена BGL1 из семейства Bcl2, гена MDR1, детерминирующего множественную лекарственную устойчивость клеток и т.д. Предполагается, что это обусловлено способностью некоторых мутантных р53 связывать белки, в частности другие факторы транскрипции, с которыми нормальный р53 не взаимодействует, и модифицировать экспрессию генов, регулируемых этими транскрипционными факторами.
3.3.3. Физиологические функции р53 и их нарушения в неопластических клетках
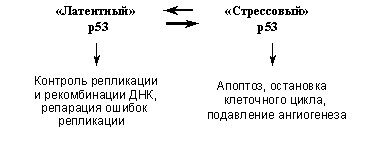
Молекулы белка р53 могут находиться в различных конформационных состояниях, в которых они обладают разными биохимическими активностями и выполняют разные физиологические функции. В обычных условиях р53 находится в так называемой латентной форме, в которой он обладает слабой транскрипционной активностью. Такой р53, однако, связывает белки репарационной машины (см. выше), проявляет активность 3′-5′-экзонуклеазы и стимулирует рекомбинацию и репарацию ДНК. При различных стрессах и внутриклеточных повреждениях происходят пост-трансляционные модификации, в частности фосфорилирование и ацетилирование определенных аминокислот молекулы р53, определяющие ее переход в так называемую стрессовую конформацию. Такой р53 значительно более стабилен (т.е. резко увеличивается его количество в клетке) и эффективно транс-активирует и/или транс-репрессирует специфические гены-мишени, следствием чего является индукция в аномальных клетках либо остановки клеточного цикла, либо апоптоза. Кроме того, активация р53 ведет к изменению экспрессии генов некоторых секретируемых факторов, в результате чего может изменяться размножение и миграция не только поврежденной, но и окружающих клеток. При этом, находясь в стрессовой конформации, р53 в значительной степени утрачивает активности, стимулирующие рекомбинацию и/или репарацию ДНК.
р53 дикого типа, в дополнение к латентной и стрессовой, может временно приобретать и так называемую мутантную конформацию, сходную с той, в которую молекула р53 необратимо переходит при онкогенных мутациях. Транзиторный переход р53 в мутантную конформацию происходит при воздействии определенных цитокинов и/или морфогенов (PDGF, тромбопоэтин, ретиноевая кислота и др.). Биологический смысл такого перехода пока неясен. Возможно, он заключается в полной инактивации рост-ингибирующих активностей р53 и/или изменении набора его генов-мишеней.
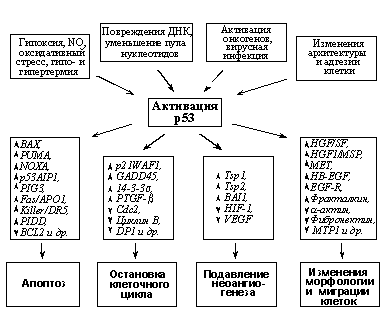
Таким образом, р53 играет важную охранную роль, являясь по образному выражению D.Lane, «стражем генома». Его повседневная функция заключается, по-видимому, в распознавании и исправлении ошибок, неизменно возникающих в ходе репликации ДНК. При массивных повреждениях ДНК, других внутриклеточных нарушениях или угрозе их возникновения происходит переключение функций р53 (Рис. 4): приобретая транскрипционные активности и изменяя экспрессию генов-мишеней, он вызывает либо остановку размножения аномальных клеток (временную, для устранения повреждений, или необратимую), либо их гибель (факторы, определяющие судьбу клетки при активации р53 будут рассмотрены ниже). В результате устраняется возможность накопления в организме генетически измененных клеток.
Механизмы активации р53 при стрессах и внутриклеточных повреждениях. Активация транскрипционных функций р53 наблюдается при самых разнообразных стрессах и внутриклеточных нарушениях: УФ- и g-облучении, присутствии в клетке разорванной ДНК, понижении внутриклеточного пула нуклеотидов, ингибировании ДНК- и РНК-полимераз, гиперэкспрессии онкогенов, вирусной инфекции, гипоксии, оксидативном стрессе, гипо- и гипертермии, различных нарушениях клеточной архитектуры (увеличении числа ядер, изменениях цитоскелета и адгезии) и т.д.
Ключевую роль в стабилизации белка р53 и повышении его транскрипционной активности играют изменения взаимодействия р53 с белком-ингибитором Mdm2, ген которого является потенциальным онкогеном. Белок Mdm2 связывается с N-концом молекулы р53 и, обладая активностями Е3 убиквитин-лигазы, стимулирует убиквитинизацию и, как результат, протеосомную деградацию белка р53. Поэтому, в норме уровень экспрессии р53 очень невелик, а время его жизни составляет всего около 30 минут. Кроме того, связываясь с N-концевым участком р53 в районе домена, взаимодействующего с базовыми факторами транскрипции, Mdm2 подавляет способность р53 транс-активировать гены-мишени.
Рис. 4. Охранные функции р53.
А). Функции «латентной» и «стрессовой» форм р53.
Б) Факторы, вызывающие транскрипционную активацию р53, гены-мишени активированного р53 и вызываемые изменениями их экспрессии биологические эффекты.
Важную роль в приобретении молекулами р53 конформации, способной транс-активировать гены-мишени, играют также модификации С-концевого участка, а именно ацетилирование его определенных аминокислотных остатков. При повреждениях ДНК и экспрессии активированного онкогена RAS эти события инициируются связыванием освобождающегося от Mdm2 N-концевого участка p53 с базальным фактором транскрипции р300/CBP, ацетилирующим сначала ингибиторный домен р53 по лизинам 373 и 382, а затем (после связывания р53 с респонсивными элементами) и белки хроматина в области генов-мишеней. Таким образом, последовательные пост-трансляционные модификации N-концевого и С-концевого участков р53 вызывают увеличение количества белка р53 в клетке, приобретение им способности связывать р53-респонсивные элементы и рекрутировать к генам мишеням базовые факторы транскрипции (компоненты комплекса TFIID РНК-полимеразы II и гистоновые ацетилазы p300/CBP, деконденсирующие хроматин), стимулируя тем самым транскрипцию их мРНК.
При некоторых стрессах, в частности при гипоксии, наблюдаются пост-трансляционные изменения р53, вызывающие его переход не к классической стрессовой конформации, а к ее варианту. Такой р53 не транс-активирует гены, содержащие р53-респонсивные элементы, но подавляет транскрипцию других генов-мишеней. Эта, так называемая репрессионная, форма также фосфорилирована по N-концу, но ее С-концевой участок не ацетилирован и связывает репрессионные комплексы Sin3/HDAC, вызывающие конденсацию хроматина генов-мишеней.
Гены-мишени р53 и их функции. В настоящее время, помимо Mdm2, обеспечивающего регуляцию самого р53 по принципу обратной связи (см. выше), идентифицировано более сотни генов, являющихся мишенями транскрипционных активностей р53. Они могут быть разделены на несколько групп, исходя из их физиологических функций (Рис. 4Б).
Идентифицирован также ряд генов-мишеней р53, продукты которых вызывают остановку в фазе G2 (задержка в ней наблюдается в случае, когда р53 активировался уже после того как клетка прошла G1-чекпойнт, или в клетках с инактивированным G1-чекпойнтом). Активированный р53 подавляет функцию комплекса циклин B/Cdc2, играющего ключевую роль в переходе из G2 в митоз, по нескольким механизмам. Во-первых, он транс-активирует ген 14-3-3-s, белковый продукт которого связывает и секвестрирует комплексы циклин B/Cdc2 в цитоплазме, не давая возможности им попасть в ядро, где они и должны проявлять свою активность. Во-вторых, он транс-активирует ген GADD45, белковый продукт которого обладает способностью связывать Сdc2, разрушая таким образом комплексы циклин B/Cdc2. В-третьих, р53 репрессирует транскрипцию генов циклина B и Cdc2, что уменьшает синтез их продуктов. Следует заметить, что, как и в случае остановки клеточного цикла в G1, задержка в G2 при повреждениях ДНК наблюдается и в клетках с инактивированным р53: она происходит в результате подавления функции фосфатаз Cdc25 (Cdc25A при остановке в G1 и Cdc25C при остановке в G2), активирующих соответствующие цикдинзависимые киназы. Однако в клетках с нарушенной функцией р53 происходит лишь кратковременная задержка в чекпойнтах, а активация р53 обеспечивает длительную остановку клеточного цикла, предотвращающую размножение вплоть до исправления дефекта.
Выявлено еще несколько десятков генов-мишеней р53. Среди них следует отметить ген каталитической субъединицы теломеразы (TERT), который репрессируется р53 (таким образом, р53 участвует, по-видимому, и в обеспечении репликативного старения клеток. По-видимому, р53 принимает участие и в процессах созревания клеток, так как некоторые из транс-активируемых им генов кодируют белки репертуара той или иной дифференцировки (мышечная креатинкиназа и др.).
3.3.4. Гомологи р53: р63 и р73