Сульфат меди что это такое
Медный купорос
Сульфат меди(II) — (CuSO4) — бесцветные кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.
Содержание
Строение кристаллогидрата
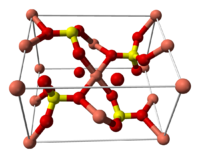
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2- по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Свойства
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650°С:
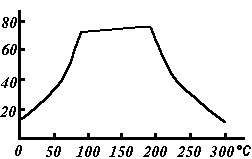
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.)
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Окрашивает огонь в зелёный цвет.
Применение
Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком — от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а так же для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).
В природе изредка встречается минерал Халькантит, состав которого близок к CuSO4*5H2O
См. также
Полезное
Смотреть что такое «Медный купорос» в других словарях:
МЕДНЫЙ КУПОРОС — (сульфат меди), CuSO4?5H2O, лазурно синие кристаллы, tпл 95,88шC. Встречается в природе в виде минерала. Медный купорос применяют как протраву при крашении, для консервирования древесины, как пестицид, антисептик и вяжущее лекарственное средство … Современная энциклопедия
МЕДНЫЙ КУПОРОС — CuSO4.5H2O, см. Меди сульфат … Большой Энциклопедический словарь
МЕДНЫЙ КУПОРОС — м л, син. халькантита. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
медный купорос — CuSO4·5H2О, см. Меди сульфат. * * * МЕДНЫЙ КУПОРОС МЕДНЫЙ КУПОРОС, CuSO4·5H2O, см. Меди сульфат (см. МЕДИ СУЛЬФАТ) … Энциклопедический словарь
медный купорос — vario(II) sulfatas pentahidratas statusas T sritis chemija formulė CuSO₄·5H₂O atitikmenys: angl. copper(II) sulfate pentahydrate rus. меди(II) сульфата пентагидрат; медный купорос ryšiai: sinonimas – vario tetraoksosulfatas pentahidratas… … Chemijos terminų aiškinamasis žodynas
Медный купорос — (синий) (техн.), или серно медная соль CuSO4.5H2O встречается в природе, как вторичное образование, в виде кристаллов и натечных масс, или в виде раствора, в так называемых цементных водах. М. купорос известен был уже в древности, и Плиний, напр … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
медный купорос — синий купорос … Cловарь химических синонимов I
Медный купорос — кристаллогидрат Меди сульфата состава CuSO4 ․5H2O … Большая советская энциклопедия
МЕДНЫЙ КУПОРОС — сернокислая медь в кристаллах синего цвета. В чистом виде применяется только для опрыскивания деревьев в безлиственном состоянии (1 % раствор М. к., т. е. 1 кг М. к. на 100 л воды), чаще же в смеси с известковым молоком (см. Бордосская жидкость)… … Сельскохозяйственный словарь-справочник
МЕДНЫЙ КУПОРОС — см. Меди сульфат. МЕДЬ хим. элемент, символ Си (лат. Cuprum), ат. н. 29, ат. м. 63,546. М. розово красный металл; плотн. 8920 кг/м3. tпл 1084,5 °С. В природе изредка встречается в виде самородной М. и в виде соединений с серой (сульфидов) или… … Большой энциклопедический политехнический словарь
Сульфат меди(II)
| Сульфат меди(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Меди(II) сульфат |
| Традиционные названия | Медный купорос |
| Химическая формула | CuSO4 |
| Физические свойства | |
| Молярная масса | 159,61 г/моль |
| Плотность | 3,60 г/см³ |
| Термические свойства | |
| Химические свойства | |
| pKa | 5·10 −3 |
| Растворимость в воде | 31,6 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | Триклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| RTECS | GL8800000 |
Сульфат меди(II) (CuSO4) — медная соль серной кислоты, белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос.
Содержание
Получение
В промышленности получают растворением Cu и медных отходов в разб. H2SO4 при продувании воздуха; растворением CuO в H2SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.

В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Температура не должна превышать 60 градусов Цельсия, так как образуется побочный продукт:
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди (II) серной кислотой:
Очистка
Физические свойства
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
Растворимость
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80-200 °C). (см. рис.)
Химические свойства
Диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:

Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-

Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu 2+ окрашивает пламя в зеленый цвет.
Применение
Сульфат меди(II) — наиболее важная соль меди — часто служит исходным сырьём для получения других соединений. Например, гидроксида меди (II) — Cu(OH)2 — вещества, необходимого для качественных реакций на глюкозу, глицерин.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят обезвоживание этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордоской смеси с известковым молоком — от грибковых заболеваний и виноградной тли. Для этих целей сульфат меди (II) имеется в розничной торговле.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Токсикологические данные
Первая помощь при отравлении
При попадании вещества на кожу необходимо снять его ватой или куском ткани, затем обмыть прохладной водой с мылом. При попадании в глаза необходимо обильно промыть их проточной водой. При попадании через дыхательные пути нужно вывести пострадавшего на свежий воздух, прополоскать рот водой. При попадании в желудочно-кишечный тракт необходимо промыть желудок пострадавшего 0,1%-ым раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1-2 ложки, вызвать рвоту, дать мочегонное.
Безопасность
Хранить в сухом прохладном месте при температуре от −30 до +30 °C, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте. Запрещается хранение вещества в поврежденной упаковке.
Производители и поставщики
Сульфат меди (II), как средство от гниения, сорняков и т. д. находится в розничной продаже в супермаркетах и хозяйственных магазинах. Чаще всего на прилавках можно найти упаковку весом в 100 граммов. Производство данной продукции осуществляется компанией ЗАО Фирма «Август». Также медный купорос можно найти в химических магазинах разной фасовки. Обычно это пластиковые банки весом в 1 кг или полиэтиленовые мешки весом в 500 г.
Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO4 ∙ 5H2O
Сульфат меди и медный купорос, характеристика, свойства и химические реакции
Сульфат меди и медный купорос, характеристика, свойства и химические реакции.
Сульфат меди – неорганическое вещество, имеет химическую формулу CuSO4.
Краткая характеристика сульфата меди:
Сульфат меди – неорганическое вещество белого цвета.
Химическая формула сульфата меди CuSO4.
Сульфат меди – неорганическое химическое соединение, соль серной кислоты и меди.
С водой сульфат меди образует кристаллогидраты: пентагидрат сульфата меди CuSO4·5H2O, именуемый также медный купорос, тетрагидрат сульфата меди CuSO4·4H2O, тригидрат сульфата меди CuSO4·3H2O, гидрат сульфата меди CuSO4·H2O.
Растворим также в глицерине, метаноле, этиленгликоле. Не растворим в ацетоне, этаноле.
Сульфат меди негорюч, пожаро- и взрывобезопасен.
Сульфат меди является пищевой добавкой Е519.
В природе сульфат меди встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Краткая характеристика медного купороса:
Медный купорос – неорганическое вещество синего цвета различных оттенков.
Химическая формула медного купороса CuSO4·5H2O.
Медный купорос – пентагидрат сульфата меди.
Хорошо растворяется в воде. Растворим также в глицерине, метаноле, этаноле, этиленгликоле.
На воздухе постепенно выветривается (теряет кристаллизационную воду).
Медный купорос негорюч, пожаро- и взрывобезопасен.
Медный купорос относится к веществам 2-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата меди:
| Наименование параметра: | Значение: |
| Химическая формула | CuSO4 |
| Синонимы и названия иностранном языке | copper(II) sulphate (сopper(II) sulfate (англ.) |
халькокианит (рус.)
Физические свойства медного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | CuSO4·5H2O |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
copper(II) sulfate pentahydrate (англ.)
меди(II) сульфат пентагидрат (рус.)
медный купорос (рус.)
медь сернокислая пятиводная (рус.)
халькантит (рус.)
Химические свойства сульфата меди. Химические реакции сульфата меди и кристаллогидратов меди:
1. реакция сульфата меди и железа :
2. реакция сульфата меди и цинка :
В результате реакции образуются сульфат цинка и медь.
3. реакция сульфата меди и олова :
В результате реакции образуются сульфат олова и медь.
4. реакция взаимодействия сульфата меди, меди и хлорида натрия:
CuSO4 + Cu + 2NaCl → 2CuCl + Na2SO4 (t = 70 °C).
В результате реакции образуются хлорид меди и сульфат натрия.
5. реакция взаимодействия сульфата меди и аммиака :
В результате реакции образуется сульфат тетраамминмеди (II).
6. реакция взаимодействия сульфата меди и гидроксида натрия:
7. реакция взаимодействия сульфата меди и гидроксида калия:
В результате реакции образуются сульфат калия и гидроксид меди.
8. реакция взаимодействия сульфата меди и гидроксида лития:
В результате реакции образуются сульфат лития и гидроксид меди.
9. реакция взаимодействия сульфата меди и гидроксида кальция:
В результате реакции образуются сульфат кальция и гидроксид меди.
10. реакция взаимодействия сульфата меди и сульфида калия:
В результате реакции образуются сульфат калия и сульфид меди.
11. реакция взаимодействия сульфата меди и хлорида бария:
В результате реакции образуются сульфат бария и хлорид меди.
12. реакция взаимодействия сульфата меди и сульфита натрия:
В результате реакции образуются сульфат натрия и сульфит меди.
13. реакция взаимодействия сульфата меди и сульфата железа (II) :
В результате реакции образуются медь и сульфат железа (III). В ходе реакции используется концентрированный раствор сульфата железа (II).
14. реакция термического разложения сульфата меди:
15. реакция термического разложения кристаллогидратов сульфата меди:
Пентагидрат сульфата меди CuSO4·5H2O разлагается на тетрагидрат сульфата меди CuSO4·4H2O и воду.
Тетрагидрат сульфата меди CuSO4·4H2O разлагается на гидрат сульфата меди CuSO4·H2O и воду.
Гидрат сульфата меди CuSO4·H2O разлагается на сульфат меди CuSO4 и воду.
Применение и использование сульфата меди и медного купороса:
Сульфат меди и медный купорос используется во множестве отраслей промышленности и для бытовых нужд:
– в химической промышленности как исходное сырьё для получения других соединений меди ;
– в сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение ;
– в пищевой промышленности в качестве пищевой добавки 519 как фиксатор окраски и консервант;
– в быту для выведения пятен ржавчины на потолке после затоплений.
Примечание: © Фото //www.pexels.com, //pixabay.com
сульфат меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата меди
реакции