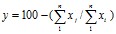Сульфасалазин не помогает что делать
Сульфасалазин не помогает что делать
Важно отметить, что терапия больных ЯК должна проводиться строго индивидуально с учетом характера заболевания, распространенности процесса, степени тяжести обострения и чувствительности пациента к тем или другим препаратам. В то же время, невозможно осуществить индивидуальный подбор лекарственных средств до начала лечения, в связи с чем, в большинстве случаев используется стандартная терапия.
Развитие побочных эффектов, в ряде случаев, заставляет отменять сульфасалазин или снижать его дозу, что, в конечном счете, снижает эффективность лечения [3, 8]. Таким образом, поиск критериев, позволяющих оценить риск развития побочных эффектов сульфасалазина у больных ЯК на начальных стадиях его применения, представляет значительный практический интерес. Наличие в арсенале врача простых надежных критериев прогнозирования риска развития побочных эффектов у конкретного больного ЯК на ранних стадиях лечения сульфасалазином позволяет своевременно вносить изменения в проводимую терапию и, тем самым, улучшить ее результаты.
Цель исследования. Поиск критериев и разработка метода оценки риска развития побочных эффектов на ранних стадиях монотерапии сульфасалазином у больных язвенным колитом.
Материалы и методы исследования
Под наблюдением находились 67 больных с легким и среднетяжелым течением ЯК. Диагноз устанавливался при наличии характерных симптомов и подтверждался при эндоскопическом обследовании толстой кишки и гистологическом исследовании биоптатов слизистой оболочки. Сульфасалазин назначался в средней дозе 3,0 г/сутки. Больные, принимавшие, наряду с сульфасалазином, кортикостероиды и другие препараты, в исследование не включались.
Перед началом лечения и повторно через 7-10 дней у всех пациентов оценивалось качество жизни с помощью опросника SF-36. В процессе наблюдения все пациенты, включенные в исследование, заполняли специальный дневник, где отмечали побочные эффекты сульфасалазина с указанием времени их появления. Для статистической обработки применяли пакеты программ «MICROSOFT EXCEL» и «STATISTICA-6.0». Проверка нормальности распределения осуществлялась с помощью теста Колмогорова-Спирина. Показатель достоверности оценивали по Стьюденту. Различия оценивались как достоверные при вероятности 95% (Р 0,05). Аналогичная тенденция обнаруживалась по значениям болевых ощущений, жизнеспособности, ролевого эмоционального функционирования.
В целом, можно говорить о том, что низкие значения показателей по шкалам опросника SF-36 являются неблагоприятным прогностическим фактором в плане развития побочных эффектов сульфасалазина при лечении ЯК. Однако полученные данные не могут выступать в качестве четкого прогностического критерия развития побочных эффектов сульфасалазина у конкретного больного ЯК в связи с высокой его вариабельностью. Для устранения данного недостатка мы воспользовались не абсолютными значениями показателя качества жизни, а их динамикой за первые 7- 10 дней после начала приема сульфасалазина (таблица 2). При этом использовались не отдельные показатели шкал опросника SF-36, а их интегральные значения по формуле 1:
Соотношение изменений суммарного показателя качества жизни с частотой и сроками развития побочных эффектов сульфасалазина у больных язвенным колитом
Изменение суммарного показателя качества жизни в % за 7-10 первых дней монотерапии сульфасалазином
Сроки появления побочных эффектов (недели)
Проявления побочных эффектов сульфасалазина (%)
Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
Диагноз ревматоидного артрита ставится на основании:
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
Биологические (генно-инженерные) БПВП – биологические агенты
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Рациональная терапия идиопатического анкилозирующего спондилоартрита
Идиопатический анкилозирующий спондилоартрит (ИАС), или болезнь Бехтерева, является основной нозологической формой серонегативных спондилоартритов. Это заболевание характеризуется хроническим прогрессирующим течением и приводит к анкилозированию илиосакр
Идиопатический анкилозирующий спондилоартрит (ИАС), или болезнь Бехтерева, является основной нозологической формой серонегативных спондилоартритов. Это заболевание характеризуется хроническим прогрессирующим течением и приводит к анкилозированию илиосакральных и межпозвонковых суставов, обызвествлению спинальных связок и ограничению подвижности позвоночника. При ИАС воспалительный процесс не ограничивается только поражением осевого скелета. Для этого заболевания типичны артриты грудино-реберных, грудино-ключичных и височно-нижнечелюстных суставов и, конечно, артриты периферических суставов, за исключением межфаланговых, пястно- и плюснефаланговых. Но наибольшее значение имеет вовлечение в патологический процесс корневых суставов, и прежде всего тазобедренных. Подобная симптоматика встречается у трети больных и всегда является показателем неблагоприятного прогноза и ранней инвалидизации. Важное место занимает и энтезопатия, определяющая разнообразную клинико-рентгенологическую симптоматику (талалгия, капсулиты тазобедренных суставов, эрозии, остеосклероз, остеофитоз, периостальные наслоения на пяточных костях или костях таза). Синдесмофиты также рассматриваются как проявление генерализованной энтезопатии. Для ИАС характерны и разнообразные системные проявления, в частности аортит, аортальные пороки сердца, серьезные нарушения проводимости, вплоть до полной поперечной блокады, рестриктивная дыхательная недостаточность, вторичный реактивный амилоидоз, IgA-нефропатия, острый передний увеит, арахноидит нижней части спинного мозга с чувствительными и двигательными нарушениями.
Распространенность ИАС колеблется, по данным разных авторов, от 0,1 до 1,4% и даже достигает 2,5% среди взрослого населения эскимосов Аляски. Риск развития этой патологии существенно повышается у носителей HLA-B27. Социальное значение ИАС подчеркивается тем обстоятельством, что эта болезнь начинается в молодом возрасте, а пик заболеваемости приходится на 20–30 лет. Общепринятой является точка зрения, что ИАС чаще встречается и тяжелее протекает у мужчин. Однако при ретроспективном исследовании большой группы пациентов с этим заболеванием оказалось, что многие проявления, включая боль в пояснице и увеит, с одинаковой частотой встречаются как у мужчин, так и у женщин, в то время как периферический артрит чаще диагностируется у лиц женского пола.
Патоморфология ИАС имеет существенные отличия от патоморфологии ревматоидного артрита (РА), что, по-видимому, и определяет особенности ответа больных на лекарственную терапию. Если при РА воспалительный процесс локализуется в синовиальной оболочке, то при ИАС — не столько в синовии, сколько в энтезах и костях, что в равной степени относится и к периферическим суставам, и к позвоночнику, где формирование синдесмофитов можно рассматривать как частный вариант генерализованной энтезопатии. Морфологические изменения при ИАС находят свое отображение в рентгенологической картине. Рентгенография таза и позвоночника, а при необходимости и суставов является облигатным методом исследования и позволяет охарактеризовать объем и степень выраженности патологических стигматов и верифицировать диагноз.
Клиническая картина ИАС характеризуется выраженной гетерогенностью. Возможны случаи с изолированным поражением позвоночника (центральная форма), с одновременным поражением позвоночника и корневых (ризомелическая форма) или периферических суставов. Воспалительный процесс в позвоночнике проявляется двусторонним сакроилеитом, оссификацией связок позвоночника и/или наружных отделов фиброзного кольца с формированием единичных или множественных синдесмофитов, эрозированием передних углов позвонков и изменением их формы, деструкцией дисков и их оссификацией, вовлечением межпозвонковых и реберно-позвонковых суставов. Однако во всех случаях наблюдается прогрессирующее поражение осевого скелета с нарастающим ограничением подвижности позвоночника и его деформацией. При поражении тазобедренных суставов отмечается особенно неблагоприятный прогноз с ранней и стойкой инвалидизацией больных, а часто и с необходимостью проведения эндопротезирования пораженного сустава. В целом для тяжелых случаев ИАС характерно столь же низкое качество жизни, как и при тяжелых случаях ревматоидного артрита. По данным M. M. Ward (1999), снижение качества жизни объясняется выраженной скованностью, наблюдающейся при этом заболевании у 90% пациентов, болью (83%), повышенной утомляемостью (62%), плохим сном (54%), тревогой за будущее (50%) и побочными явлениями от проводимой медикаментозной терапии (41%).
О тяжести ИАС можно судить и на основании того, какой процент больных имеет стойкую потерю трудоспособности. При детальном проспективном изучении анамнеза 100 больных выяснилось, что стойкая потеря трудоспособности в среднем наступает спустя 15,6 лет от начала болезни. Инвалидность при этом заболевании ассоциируется с низким уровнем образования, полной оссификацией позвоночника, острым передним увеитом, женским полом и наличием сопутствующих заболеваний. Относительный риск летальных исходов при ИАС выше по сравнению с общей популяцией на 50%, причем превосходит в 4 раза риск смерти от желудочно-кишечных осложнений, в 2 раза — от несчастных случаев, в 2 раза — от суицида, в 2 раза — от цереброваскулярной недостаточности и в 1,4 раза — от циркуляторных нарушений. Предикторы тяжелого течения ИАС включают большое число клинико-рентгенологических, лабораторных и генетических факторов, что следует учитывать при определении терапевтической тактики в отношении этого заболевания. При их наличии медикаментозная терапия должна быть особенно активной, кроме того, ее следует начинать как можно раньше, так как темпы прогрессирования ИАС наиболее высоки в первые годы болезни.
Факторы риска тяжелого течения ИАС:
Основными принципами терапии АС являются ее индивидуализация, этапность и комплексный подход с воздействием на различные параметры патологического процесса. Она должна быть направлена на купирование боли и подавление воспаления (симптом-модифицирующая терапия), профилактику прогрессирования структурных изменений или существенное снижение темпов их развития (болезнь-модифицирующая терапия), а также восстановление функции опорно-двигательного аппарата, что и предусматривается широким диапазоном реабилитационных мероприятий. Объем и содержание терапии в каждом конкретном случае определяются клинической формой заболевания, степенью активности воспалительного процесса, наличием и выраженностью системных проявлений, функциональной способностью суставов и позвоночника (таблица).
Этиотропная терапия при ИАС не проводится. Активно обсуждается роль условно патогенной кишечной инфекции в качестве триггерного фактора этого заболевания, но пока она не доказана, а назначение антибиотиков на любом этапе развития ИАС, включая дебют заболевания, не дает положительного эффекта. Основой лечения является использование разнообразных противовоспалительных средств. Применение такой терапии направлено как на подавление воспалительного процесса в позвоночнике, суставах и воспаленных энтезах, так и на замедление темпов прогрессирования заболевания, что, по существу, и составляет основу вторичной профилактики необратимых изменений в опорно-двигательном аппарате.
Симптоматическая терапия ИАС предусматривает в первую очередь применение нестероидных противовоспалительных препаратов (НПВП). Эти препараты являются основой медикаментозной терапии и облигатным компонентом комбинированной терапии ИАС. Они быстро снижают интенсивность боли как в периферических суставах, так и в позвоночнике, а также продолжительность и выраженность утренней скованности. Положительный эффект этих препаратов в первые 48 ч их приема рассматривается в качестве одного из диагностических критериев ИАС. Интересно, что если больной не отвечает на терапию НПВП, то вероятность наличия у него ИАС составляет всего 3%. Активное воздействие на два основных проявления этого заболевания, а именно болевой синдром и ригидность, позволяет рассматривать НПВП в качестве препаратов первой линии в лечении ИАС. Однако следует иметь в виду, что они не замедляют темпы прогрессирования структурных изменений, в том числе и у больных, положительно реагирующих на их применение.
Наиболее высокой эффективностью при ИАС обладает фенилбутазон, который позволяет контролировать основные симптомы этого заболевания: боль, припухлость суставов и ригидность. Антивоспалительное действие фенилбутазона наиболее ярко проявляется именно при этом заболевании, что позволяет думать об определенных особенностях, которые имеет воспалительный процесс у больных ИАС. Однако этот препарат используется лишь в исключительных случаях, так как способствует развитию серьезных побочных реакций, прежде всего гематологических цитопений, вплоть до апластической анемии. Высоким терапевтическим потенциалом при этом заболевании обладают и производные индолуксусной кислоты — индометацин и метиндол. Некоторые больные принимают эти препараты на протяжении многих месяцев и даже лет. Производные индола также обладают широким спектром побочных реакций, включая поражение почек, желудочно-кишечную токсичность, задержку жидкости, токсические явления со стороны центральной нервной системы. Многие авторы отмечают, что переносимость этих препаратов у больных с ИАС обычно лучше, чем у пациентов с другими заболеваниями. Другие НПВП (кетопрофен, флурбипрофен, диклофенак, пироксикам, мовалис) также широко применяются для лечения ИАС. В ряде двойных слепых исследований, при сравнительной оценке НПВП с индометацином и фенилбутазоном, было выявлено, что они имеют почти одинаковый терапевтический эффект. Так, в двойном слепом рандомизированном исследовании флурбипрофен (150–200 мг/сут) показал такую же эффективность, как и индометацин (75–100 мг/сут) при подавлении боли и числа воспаленных суставов.
При лечении аэрталом больных ИАС удается добиться лучшего соотношения индекса эффективность/безопасность, при том что антивоспалительное его действие эквивалентно стандартным НПВП. В мультицентровом двойном слепом параллельном исследовании аэртала 100 мг и индометацина 100 мг, проведенного Batle-Gauda и соавт. (1996), было показано, что оба препарата активно воздействуют на такие параметры патологического процесса, как боль, утренняя скованность, подвижность в поясничном отделе позвоночника по модифицированному индексу Шобера, глобальная оценка болезни пациентом и врачом. Достоверных различий оцениваемых показателей в двух группах больных не было выявлено. В то же время аэртал вызывает меньше нежелательных эффектов, чем индометацин и другие «традиционные» НПВП. Так, метаанализ безопасности ацеклофенака, основанный на 13 двойных слепых, рандомизированных исследованиях, в которых приняли участие 3574 больных с остеоартрозом, ревматоидным артритом или с анкилозирующим спондилоартритом, продемонстрировал лучший профиль безопасности по сравнению с классическими НПВП, включая диклофенак, индометацин, напроксен, пироксикам и теноксикам. При лечении ацеклофенаком в 1,38 раза реже встречались нежелательные явления по сравнению с группой больных, лечившихся традиционными НПВП, при этом отмена терапии в связи с его токсичностью также встречалась достоверно реже, чем у больных группы сравнения.
При наличии выраженной ригидности применяют миорелаксанты (мидокалм, баклофен, сирдалуд). Продолжительная и выраженная ригидность являются проявлением высокой активности воспалительного процесса, причем отображает ее в большей степени, чем лабораторные тесты. У больных ИАС наблюдается и рефлекторное напряжение мышц, которое, в свою очередь, еще более способствует ограничению подвижности позвоночника, вызванного прежде всего структурными изменениями. Некоторые авторы рассматривают повышение мышечного тонуса как один из факторов риска быстрого прогрессирования этого заболевания. Миорелаксанты способствуют уменьшению мышечного тонуса и более выраженной ригидности, а это приводит к увеличению амплитуды движений в позвоночнике и периферических суставах, что и делает их назначение целесообразным.
К симптом-модифицирующей терапии относятся и глюкокортикостероиды (ГКС). Гормональная терапия имеет свои особенности при ИАС. Повседневный опыт позволяет констатировать, что системная ГКС-терапия при этом заболевании менее эффективна по сравнению, например, с РА. Это можно объяснить незначительной выраженностью воспалительного процесса в периферических суставах и суставах позвоночника либо полным отсутствием воспалительного процесса и в то же время преобладанием у некоторых больных многочисленных энтезитов. Нередко имеет место диссонанс между его клинической и лабораторной активностью, чем и обусловлено мнение некоторых авторов о нецелесообразности выделения степени активности при ИАС. Особенности ответа организма на ГКС у больных ИАС определяются также небольшим участием гуморального звена иммунитета в развитии и прогрессировании этого заболевания.
И все же при ИАС приходится прибегать как к локальной, так и к системной терапии ГКС. Хороший эффект дает локальное (внутрисуставно или периартикулярно) применение пролонгированных ГКС. Их назначение обосновано при ограниченном числе пораженных суставов, высокой местной активности, упорном, рефрактерном к другим видам терапии синовите. Системное применение ГКС обосновано у больных с ярко выраженными экссудативными явлениями в суставах, полиартикулярном характере поражения, упорном коксите, длительном персистировании высоких концентраций острофазовых белков, максимальной активности воспалительного процесса на протяжении трех и более последующих месяцев, а также у больных с серьезными и множественными системными проявлениями. Доза преднизолона обычно составляет 5–10 мг/сут, иногда ее увеличивают, но не более чем до 15–20 мг/сут.
В некоторых случаях, при максимальной активности воспалительного процесса и торпидности к другим видам медикаментозного лечения, приходится прибегать к пульс-терапии высокими дозами метипреда, которую проводят, руководствуясь теми же принципами, что и при РА. Однако эффект от пульс-терапии оказывается не столь разительным. Возможно, это связано с отсутствием генерализованного васкулита, присущего РА. Во всяком случае, при ИАС нет показаний к применению мегадоз циклофосфана, имеющего тропность к эндотелию сосудов.
Показания к системному применению глюкокортикостероидов при ИАС:
Болезнь-модифицирующая терапия (БМТ) при ИАС менее детально разработана, чем при хронических воспалительных заболеваниях суставов. Такая терапия в первую очередь показана больным АС с умеренной и высокой воспалительной активностью, рефрактерностью к НПВП и кортикостероидам или серьезными нежелательными явлениями на эти препараты, а также пациентам с предикторами дальнейшего неблагоприятного течения заболевания. Но по существу она должна проводиться у всех больных с целью предотвращения прогрессирования структурных изменений в суставах и позвоночнике или снижения темпов такого прогрессирования. Важным аспектом БМТ ИАС является ее как можно более раннее назначение, так как известно, что формирование синдесмофитов и анкилозов межпозвонковых и реберно-позвонковых суставов особенно активно происходит в первые годы болезни.
Спектр препаратов для проведения БМТ у больных ИАС ограничен. Хинолиновые производные, Д-пеницилламин или соли золота не применяются из-за их неэффективности. Это же в равной степени касается азатиоприна. J. Brandt и соавт. (2000) продемонстрировали в двойном слепом исследовании его низкую терапевтическую активность и высокую токсичность, которая явилась поводом к прерыванию лечения у 68% больных.
Эффективность и переносимость сульфасалазина изучена в ходе многочисленных двойных слепых исследований. Метаанализ пяти контролированных рандомизированных исследований, предусматривавших назначение сульфасалазина по 2,0–3,0 г/сут на протяжении от 3 или 6 мес, показал, что этот препарат способствует уменьшению длительности утренней скованности на 28,2%, а также ее выраженности (30,6%), боли в позвоночнике (26,7%), а у некоторых больных — и увеличению подвижности позвоночника. В то же время снижение лабораторных показателей активности воспаления (СОЭ и содержание IgA) оказалось недостоверным [11]. В более позднем мультицентровом двойном слепом плацебоконтролированном исследовании M. Dougados и соавт. (1995) проанализировали эффективность сульфасалазина у 381 больных серонегативными спондилоартритами, среди которых было 134 — с ИАС. Пациенты принимали сульфасалазин в течение 6 мес по 3,0 г/сут. В результате исследования было выявлено достоверное уменьшение глобальной активности болезни (по оценке врача и пациента), СОЭ. Динамика интенсивности боли и утренней скованности оказалась незначительной. Побочные явления, повлекшие за собой прекращение терапии, отмечались у 16% больных, принимающих сульфасалазин, и у 5% — плацебо.
Недавно группа исследователей во главе с L. J. Clegg опубликовала результаты анализа контролированного 36-недельного исследования по изучению эффективности сульфасалазина у 619 больных серонегативными спондилоартритами, включая 264 — с ИАС. Проведенный анализ позволил выявить, что сульфасалазин эффективен в отношении симптоматики периферического артрита и малоэффективен, когда речь идет о воспалительном процессе в позвоночнике. Из этого следует, что сульфасалазин должен применяться только при периферической или ризомелической форме ИАС, но не используется при изолированном поражении осевого скелета.
В повседневной практике сульфасалазин применяют в нарастающей дозе. Обычно начинают с 500 мг/сут, еженедельно прибавляя по 500 мг. Лечебная доза препарата составляет 2,0 г/сут. Действие препарата начинается спустя 6–8 нед, а наибольшая эффективность достигается спустя 12–16 нед. О рефрактерности к препарату можно говорить только к концу 4–6 мес непрерывного его приема. При неэффективности дозы 2,0 г/сут целесообразно перевести больного на дозу 3,0 г/сут. Сульфасалазин способствует развитию многообразных нежелательных явлений, хотя в целом его переносимость признана удовлетворительной. Побочные реакции включают прежде всего желудочно-кишечные нарушения (тошнота, рвота, потеря аппетита, боли в верхней половине живота). Гиперчувствительность на сульфасалазин встречается редко, но характеризуется серьезными последствиями и проявляется эпидермальным некролизом (синдромом Стивенса–Джонсона), гепатотоксичностью, гематологическими цитопениями, мегалобластной анемией. В некоторых случаях развивается олигоспермия.
В литературе представлены лишь единичные работы по изучению эффективности метотрексата при ИАС, при этом проводились в основном открытые испытания на небольшом клиническом материале. Назначение этого препарата больным, рефрактерным к НПВП, на протяжении года в дозе 12,5 мг/нед привело к уменьшению болей в суставах и их припухлости, снижению СОЭ на 25% и снижению суточной потребности в НПВП на 50% по сравнению с исходным уровнем. В другом исследовании получен хороший эффект от лечения метотрексатом при его назначении по 7,5 мг/нед в течение 3 лет. Такая терапия привела к восстановлению функциональной недостаточности опорно-двигательного аппарата, существенному снижению СОЭ и СРБ. Однако значение метотрексата в комплексной терапии ИАС пока до конца не установлено. Необходимо проведение дальнейших хорошо контролированных исследований для определения оптимальных доз метотрексата и целесообразности его применения как в качестве монотерапии, так и в комбинации с сульфасалазином, а также изучения эффективности и переносимости высоких доз метотрексата как составной части интенсивной терапии тяжелого ИАС.
При ИАС в последнее время стали применять бисфосфонаты, которые обладают антивоспалительным потенциалом. Не исключается, что они преимущественно действуют на костные структуры в местах прикрепления к ним связок, сухожилий и суставных капсул. Эффективность аминобисфосфоната (памидроната) у больных ИАС доказана как в открытых, так и рандомизированных двойных слепых исследованиях. Лечение этим препаратом в дозе 60 мг/мес внутривенно на протяжении 4 мес приводило к достоверному снижению воспалительной активности и улучшению функции суставов и позвоночника (по показателю индекса BASDAI и BASFI), уменьшению числа воспаленных и болезненных суставов на 93,8% и 98,2% соответственно, а также значительному снижению СОЭ.
Настоящим прорывом в лечении ИАС, несомненно, стало применение биологических агентов («biologics») — противовоспалительных препаратов ХХI в. Исследования последних лет расширили имеющиеся представления о патогенезе ИАС с позиций дисбаланса про- и прововоспалительных цитокинов, в котором ФНО-a занимает центральное положение. При этом заболевании повышена концентрация ФНО-a в синовиальной оболочке, воспаленных энтезах и сыворотке крови, при этом наблюдается ее ассоциация с активностью воспалительного процесса. Значения этого цитокина в сыворотке крови коррелируют с индексом активности ИАС (BASDAI).
Проведены многочисленные рандомизированные, плацебоконтролированные исследования по изучению эффективности этанерцепта и инфликсимаба (ремикейда) при ИАС. Анализ этих исследований показал, что эффективность ингибиторов ФНО-a при ИАС выше, чем при РА, причем их можно применять и в качестве монотерапии без комбинации с метотрексатом. В серии работ J. Вraun убедительно показано, что уже на следующий день после введения инфликсимаба в дозе 5 мг/кг наблюдается существенное уменьшение утренней скованности, болей в суставах и позвоночнике вплоть до полного их прекращения. У 53% больных на 12-й нед лечения наблюдается снижение cуммарного индекса активности BASDAI на 53% (по сравнению с 9% в группе плацебо). К 48-й нед половина больных соответствовала 50% снижению критериев АSAS, что расценивается как индукция ремиссии заболевания. Инфликсимаб активно воздействовал на все проявления ИАС, включая положительное влияние на проявления спондилита, артрита, энтезита, острого переднего увеита. Но особенно значимым свойством инфликсимаба является не яркий и быстро наступающий симптом-модифицирующий эффект, а торможение рентгенологического прогрессирования заболевания. Cогласно рекомендациям группы ASAS, анти-ФНО-a терапию рекомендуется проводить больным ИАС с рефрактерностью как минимум к двум НПВП, недостаточным ответом на локальную стероидную терапию и пациентам с периферической формой заболевания, у которых лечение сульфасалазином оказалось неэффективным.
Медикаментозная терапия при всей ее значимости является лишь одним, хотя и основным, компонентом комплексной терапии ИАС. Чрезвычайно важное место принадлежит физическим методам лечения и широкому диапазону реабилитационных мероприятий, направленных на профилактику и коррекцию деформации позвоночника и ограничения подвижности суставов. Лечебной физкультурой должны активно заниматься все пациенты, вне зависимости от клинической формы и воспалительной активности заболевания. Она направлена на восстановление мышечной силы и уменьшение амиотрофий и должна проводится по индивидуальным программам с применением статических и динамических упражнений. Физиотерапевтическое лечение предусматривает фонофорез гидрокортизона на воспаленные периферические и крестцово-подвздошные суставы, лазеромагнитотерапия — на область тазобедренных суставов, ионофорез хлористого лития в нарастающей концентрации (от 5% до 10%) — на позвоночник, диадинамические и синусоидально-динамические токи. Таким больным показаны повторные курсы массажа, а также лечение радоновыми или сероводородными ваннами. Высокой эффективностью обладает рентгенотерапия, но в настоящее время она проводится лишь в небольшом числе медицинских центров из-за индуцирования новообразований.
Хирургические методы лечения показаны прежде всего при тяжелых поражениях тазобедренных суставов, сопровождающихся интенсивными болями или значительным ограничением их подвижности. Артропластика одного или обоих тазобедренных суставов позволяет восстановить трудоспособность больных. К хирургической реабилитации этих больных относится коррекция тяжелых деформаций позвоночника, подвывиха атлантоаксиального сустава, устранение сгибательных контрактур крупных суставов, а также имплантация кардиостимулятора при полной поперечной блокаде или протезирование аортальных клапанов при наличии недостаточности кровообращения, рассматривающейся как проявление аортального порока сердца.
В. В. Бадокин, доктор медицинских наук, профессор РМАПО, Москва