разведение формалина пример рецепта
Заказ на изготовление препарата
Адреса аптек
Формалин 10% 200 мл
Инструкция по применению Формалина:
Формальдегидный водный раствор, стабилизированный метиловым спиртом путем неполного окисления – это Формалин. Ранее вещество использовалось только для дезинфекции помещений и различных предметов. После того, как было выяснено, что средство уплотняюще действует на белковые соединения, его начали применять в качестве консерванта тканей. Для гистологии требуется нейтральный забуференный раствор. Кроме этого, формалин хорошо помогает от потливости подмышек и ног, используется в ветеринарии.
Инструкция по применению Формалина:
Формальдегидный водный раствор, стабилизированный метиловым спиртом путем неполного окисления – это Формалин. Ранее вещество использовалось только для дезинфекции помещений и различных предметов. После того, как было выяснено, что средство уплотняюще действует на белковые соединения, его начали применять в качестве консерванта тканей. Для гистологии требуется нейтральный забуференный раствор. Кроме этого, формалин хорошо помогает от потливости подмышек и ног, используется в ветеринарии.
Показания:
Средство применяется в медицинских целях и в качестве обеззараживающей жидкости при следующих патологиях и ситуациях:
Состав:
Препарат содержит около 50 % воды, основного действующего вещества 40%. Для стабилизации раствора используется метиловый спирт, количество которого зависит от назначения – от 6 до 8%. Медицинский состав отличается более низкой концентрацией альдегида муравьиной кислоты.
Медикаментозные свойства:
Р-р формалина изготавливается на основе формальдегида, стабилизированного метиловым спиртом. Оказывает антисептическое, дезодорирующее, прижигающее воздействие. Благодаря способности ввертывать белковые соединения, фиксирует ткани, снижает секреторные функции эпителиальных желез.
В водных растворах формальдегид находится в жидкой форме, от чего легко вступает в реакции даже со слабыми реагентами, принадлежащими к группе алифатических альдегидов.
Денатурирующие свойства по отношению к белковым элементам позволяют создавать анатомические препараты, участвовать в консервации биологических материалов. Формалин 10% (нейтральный) раствор хранится долгое время, используется в гистологии, как самый распространенный фиксатор. В водных растворах формальдегид через время разлагается на муравьиную кислоту, ацетон и метиловый спирт, что приводит к ухудшению качества фиксации и выпадению осадка. Чтобы восстановить свойства вещества, необходимо подогреть до 800С.
Формалин действует в качестве антипаразитного и противогельминтного средства. Применение в ветеринарии заключается в лечении животных при отравлении карбамидом.
Быстро ликвидирует штаммы споровой подгруппы, вирусы и простейшие. Клетки антракса при обработке разрушаются и погибают в течение 2-4 часов. Избавляет от клещей, уничтожает яйца и личинки паразитов.
Раствор 1% на основе спирта назначают при сильной потливости, неприятном запахе ног.
Для дезинфекции медицинского оборудования применяется 0,5% состав.
Описание, формы выпуска:
В аптечную сеть поступает р-р формалина в виде бесцветной прозрачной жидкости с резким специфическим запахом. Выпускается во флаконах, устойчивых к коррозии. Бутылки стеклянные (200мл) и полимерные (1, 5, 10 л).
Способы применения:
В зависимости от целей используются разные концентрации формалина:
От потливости: Для очистки и ополаскивания кожи при микозах и неприятном запахе ног, подмышек назначают 0,5-3% состав. Наносят на 30-40 минут тонким слоем, затем смывают водой. Чтобы не допускать раздражения, рекомендуется обрабатывать стопы не чаще 1-2 раз в неделю. Хорошо помогают ванночки с препаратом. Необходимо начинать с малых концентраций, постепенно повышая дозировку. Срок лечения составляет около 2-3 месяцев.
Для санации обуви средство разбавляют 30% уксусной кислотой в равных пропорциях. В профилактических целях 25% раствором смачивают ватные диски, закладывают на стельки, на сутки. Это помогает устранить потливость ног и оказывает дезодорирующее воздействие.
Спринцевания: При инфекционных вагинитах, влагалищных катарах, эндометритах назначают 0,05% (20 г) вещества на 1л воды. Обработку проводят 1 раз в 7 дней на протяжении 2 месяцев.
Дезинфекция: Для обеззараживания техники, оборудования и предметов предназначен 1% раствор. Медицинские нитки и перевязочные материалы погружают в 4% состав на 24 и 72 часа, соответственно. Для обработки пальцев рук используется 0,5% средство.
Для дезинфекции помещений Формалин распыляют с помощью пульверизатора из расчета 20 мл на 1 м3 пространства при продолжительности действия 5-7 часов. После чего комнату проветривают, избыток запаха удаляют жидкостью на основе нашатырного спирта.
Гистология: Изготовление препаратов заключается в фиксации материала, создании срезов, окрашивании тканей.
Ветеринария: Для лечения животных при отравлении карбамидными веществами 0,5 мл на каждый килограмм веса растворяют в 1 000 мл воды, вводят с помощью специальной иглы в рубцовую ткань. При заражении паразитами обрабатывают кожу 4% препаратом через 2-3 дня в первую неделю, и один раз в 7 суток при необходимости продолжения терапевтических мер.
Применение при беременности: На любом сроке и в период вскармливания ребенка грудью использование препарата запрещено по причине высокой токсичности.
Противопоказания: Лекарство не назначают при восприимчивости к компонентам. Медикаментом не обрабатывают ноги и кожу при потливости, если имеется раздражение, воспалительные процессы, открытые ссадины, раны. Нельзя использовать при астме.
Сочетание с другими медикаментами: При дезинфекции Формалином не рекомендуется использовать нейтрализующие вещества: перекись водорода, аммиак.
Побочные реакции: При наружном применении могут появиться реакции на коже в виде раздражения, пересушивания, шелушения и покраснения.
Передозировка: При сильном отравлении наблюдаются поражения из-за проникновения токсичных паров и элементов в кровь. В результате прижигающего свойства развивается отмирание тканей.
В тяжелых случаях отмечалась сильная интоксикация с нарушением функции почек и печени.
Превышение концентрации при дезинфекции помещений или обработке ног сопровождается слезотечением, спазмами дыхательных органов, ожогами покровов. При попадании внутрь в качестве антидота выступают препараты на основе мочевины и нашатырного спирта. Нельзя вызывать рвоту. Очистка пищеварительных органов проводится только с помощью специального зонда.
При отравлении парами назначают ингаляции с аммиаком.
Научная электронная библиотека
Колосов А. Е., Жданова О. Б., Мартусевич А. К., Ашихмин С. П.,
Глава II. АЗИД НАТРИЯ КАК НОВЫЙ КОНСЕРВАНТ БИОЛОГИЧЕСКОГО МАТЕРИАЛА
Развитие самостоятельности будущего специалиста требует от преподавателя анализа результатов практической деятельности слушателя, качественной оценки и определения перспектив дальнейшей работы и организации методик самостоятельного обучения. В этой связи крайне актуальны не только обучение грамотной работе с интернетом (особенно эффективному использованию поисковиков), но и занятия в музеях (анатомических, патологоанатомических, биологических и др.)
В настоящее время при изучении специальных дисциплин в медицинских и биологических вузах помимо демонстрации экспериментальных моделей патологии, необходимо сохранение различных тканей, изъятых из трупов животных и человека при аналогичных заболеваниях в клинике, а также полученных в результате экспериментов студентов. Многие применяемые в настоящее время растворы для фиксации в своем составе имеют формалин в различных концентрациях, который обладает сильной бактерицидной способностью и относительной дешевизной. Наряду с достоинствами формалин имеет и ряд недостатков: угнетает обмен веществ, в первую очередь витамина С и инактивирует ферменты в органах и тканях; летуч, имеет резкий запах, пары которого вызывают раздражение и сухость слизистых оболочек; обладает мутагенным свойством. Студенты, занимаясь научно-исследовательской деятельностью помимо аудиторных занятий, в большей степени испытывают на себе действие формалина. Кроме того, биологические объекты, зафиксированные формалином, теряют подвижность и эластичность, меняют прижизненную окраску из-за перехода гемоглобина крови в метгемоглобин, в результате препараты теряют наглядность. В результате проведенных в КГМА исследований (Мешандиным А.Г., Ашихминым С.П., Зайцевой О.О., Распутиным П.Г., 2005-2007) установлено, что азидные производные обладают достаточными антибактериальными свойствами, они не летучи, не оказывают дубящего эффекта и экономически выгоднее в несколько раз растворов 10 % формалина и могут транспортироваться также в сухом виде, не имея температурных ограничений.
Мы предприняли попытку применения данного препарата для сохранения препаратов в анатомических и паразитологических музеях, и установили, что органы в физиологическом растворе с азидными производными сохраняют прижизненную окраску, форму и консистенцию, а ткань легкого не утрачивает своей воздушности. В растворе азида натрия также практически все биологические объекты (в т.ч. гельминты) сохраняют исходный цвет, форму и размер. На следующем этапе исследований провели сравнительное изучение токсичности азида натрия и формалина для лабораторных животных. Применили ингаляционное, перкутанное и внутрибрюшинное введение введение 1, 2, 4 и 5 мл 0,1 % раствора азида натрия и формалина. За животными вели наблюдение в течение 2 месяцев. В течение недели у группы животных, испытавших действие формалина (№1) отмечали активность, сменяющуюся сонливостью или ступором, аппетит неустойчивый, открытые участки кожи бледные. Но в то же время опытная группа мышей №2 отличалась активной жизнедеятельностью на протяжении всего срока эксперимента. На второй неделе констатировали изменение массы тела у всех особей опытной группы №1 с 19-21 до 17-19 г, а у особей группы №2 и контрольной масса тела не изменялась. Несомненно, чтобы максимально обеспечить наглядность препаратов и оптимизировать работу в музеях, исследования в данной области необходимо продолжать.
В целом в спектр задач, выполняемых музеями медицинских вузов, входят:
1) повышение качества образования;
2) привитие навыков учебно- и научно-исследовательской работы, работы с определителями и справочной литературой;
3) стимуляция их интереса к раскрытию закономерностей построения человека, окружающего мира, построению адекватной и логичной его картины;
4) ускорение процесса адаптации абитуриентов к новым условиям обучения и требованиям, предъявляемым к студентам вузов (ориентация на самообучение, активное использование имеющихся информационных ресурсов для получения и обновления информации). В целом музеи помимо активации познавательного интереса, нацеливают будущего специалиста на дальнейшую практическую деятельность.
Выраженность антибактериальных свойств опытного (0,05 % раствора азида натрия) и контрольного (стерильного физиологического 0,9 %) растворов в зависимости от разведений стандартных культур кишечной палочки
Опытный – 0,05 % раствор азида натрия
Контрольный –
стерильный 0,9 % физраствор
Примечание: БКИК – большое количество идентичных колоний; ММК – многочисленные мелкие колонии; СПРК – сплошной покрывающий рост колоний.
При посеве стандартных культур кишечной палочки на среды Эндо и Плоскирева, приготовленные на основе 0,05 % раствора азида натрия, при разведении опытного раствора (0,05 % раствор азида натрия) в 102 нет роста колоний, в 103 выросло 3 колонии, 104 – 19 колоний, 105 – 104 колонии, 106 – 478 колоний, 107 – многочисленные мелкие колонии, 108–109 – сплошной покрывающий рост колоний. В то время как при посеве на эти же среды стандартных культур кишечной палочки при разведении контрольного раствора (стерильный физиологический 0,9 % раствор) в 102 количество колоний составило 3, 103 – 23 колонии, 104 – 159 колоний, 105 – большое количество идентичных колоний, 106–107 – многочисленные мелкие колонии, 108–109 – сплошной покрывающий рост колоний.
Выраженность антибактериальных свойств опытного (0,1 % раствора азида натрия) и контрольного (стерильного физиологического 0,9 %) растворов в зависимости от разведений стандартных культур кишечной палочки
Опытный – 0,1 % раствор азида натрия
Контрольный – стерильный 0,9 % физраствор
Примечание: БКИК – большое количество идентичных колоний; ММК – многочисленные мелкие колонии; СПРК – сплошной покрывающий рост колоний.
При посеве стандартных культур кишечной палочки на среды Эндо и Плоскирева, приготовленные на основе 0,1 % раствора азида натрия, при разведении опытного раствора (0,1 % раствор азида натрия) с 102–103 нет роста колоний, в 104 – 2 колонии, 105 – 16 колоний, 106 – 56 колоний, 107 – 104 колонии, 108 – 278 колоний, 109 – 424 колонии. В то время как при посеве на эти же среды стандартных культур кишечной палочки при разведении контрольного раствора (стерильный физиологический 0,9 % раствор) в 102 количество колоний составило 6, 103 – 49 колоний, 104 – 410 колоний, 105 – большое количество идентичных колоний, 106 – многочисленные мелкие колонии, 107–109 – сплошной покрывающий рост колоний.
Выраженность антибактериальных свойств опытного (0,3 % раствора азида натрия) и контрольного (стерильного физиологического 0,9 %) растворов в зависимости от разведений стандартных культур кишечной палочки
Опытный –
0,3 % раствор азида натрия
Контрольный – стерильный 0,9 % физраствор
Примечание: БКИК – большое количество идентичных колоний; ММК – многочисленные мелкие колонии; СПРК – сплошной покрывающий рост колоний.
При посеве стандартных культур кишечной палочки на среды Эндо и Плоскирева, приготовленные на основе 0,3 % раствора азида натрия, при разведении опытного раствора (0,3 % раствор азида натрия) с 102–105 нет роста колоний, в 106 – 3 колонии, в 107 – 17 колоний, в 108 – 32 колонии, в 109 – 87 колоний. В то время как при посеве на эти же среды стандартных культур кишечной палочки при разведении контрольного раствора (стерильный физиологический 0,9 % раствор) в 102 количество колоний составило 5, 103 – 58 колоний, 104 – 148 колоний,
105 – большое количество идентичных колоний, 106–107 – многочисленные мелкие колонии, 108–109 – сплошной покрывающий рост колоний.
Выраженность антибактериальных свойств опытного (0,5 % раствора азида натрия) и контрольного (стерильного физиологического 0,9 %) растворов в зависимости от разведений стандартных культур кишечной палочки
Опытный –
0,5 % раствор азида натрия
Контрольный – стерильный 0,9 % физраствор
Примечание: БКИК – большое количество идентичных колоний; ММК – многочисленные мелкие колонии; СПРК – сплошной покрывающий рост колоний
При посеве стандартных культур кишечной палочки на среды Эндо и Плоскирева, приготовленные на основе 0,5 % раствора азида натрия, при разведении опытного раствора (0,5 % раствор азида натрия) с 102–106 нет роста колоний, в 107 – 2 колонии, в 108 – 9 колоний, в 109 – 24 колонии. В то время как при посеве на эти же среды стандартных культур кишечной палочки при разведении контрольного раствора (стерильный физиологический 0,9 % раствор) в 102 количество колоний составило 4, 103 – 47 колоний, 104 – 128 колоний, 105 – большое количество идентичных колоний, 106–107 – многочисленные мелкие колонии, 108–109 – сплошной покрывающий рост колоний.
Следовательно, среди применяемых нами фиксирующих растворов азида натрия наиболее оптимальными рассматриваются 0,3 и 0,5 % растворы неорганических производных азота [3, 9].
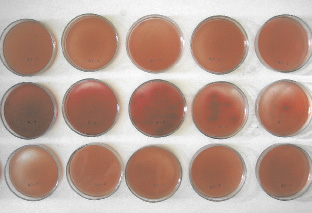
Установлено, что рост микроорганизмов на контрольном растворе (стерильный физиологический раствор) наблюдается с малых разведений и увеличивается со степенью разведения. На опытных 0,3 и 0,5 % растворах азида натрия рост микроорганизмов отсутствовал (Зайцева О.О. с соавт., 2006) (рис. 2.1).
Рис. 2.1. Фото колоний E. сoli на среде Эндо:
1 ряд – опытный раствор 0,3 % раствора азида натрия;
2 ряд – контрольный раствор (стерильный физраствор),
3 ряд – опытный раствор 0,5 % раствора азида натрия
При оценке консервирующих способностей растворов азида натрия на микроскопическом уровне выявлено, что фиксация в предложенных растворах сохраняла тинкториальные свойства гистологических препаратов: ядра прокрашивались базофильно, цитоплазма – оксифильно, четко выявлялась плазмолемма на протяжении всего срока фиксации. Целостность структуры клеточной стенки наблюдали только при сроке фиксации 30 дней (Зайцева О.О. c соавт., 2006).
Таким образом, фиксация гистологических препаратов растворами азидных производных может применяться только в ограниченные сроки, т.е. 30 суток. На втором месяце фиксации в солевых растворах азида натрия при микроскопическом наблюдении структура клеточной стенки не сохраняется (Зайцева О.О.
c соавт., 2006).
Влияние различных консервирующих растворов на сохранность макроструктуры фиксируемых органов
В результате проведенных анатомических исследований установлено, что органы в физиологическом растворе, содержащем 3 % Cu2+, имели плотную консистенцию, грязно-серый цвет с голубым оттенком, умеренную прочность при механическом воздействии на ткань. Также наблюдали незначительное уменьшение органов в размерах в результате выраженного дубящего эффекта меди на протяжении 90 суток фиксации (Мешандин А.Г. c соавт., 2006). Опыт был прекращен из-за несоответствия по данным учитываемым макроскопическим параметрам (рис. 2.2).
Рис. 2.2. Фото фрагмента почки после фиксации в физиологическом растворе с 3 % Cu2 в срок 60 суток
Органы в физиологическом растворе, содержащем Cr3+, имели очень плотную консистенцию, серо-фиолетовую окраску, крошились при механическом воздействии. На поверхности раствора наблюдали мелкоочаговый рост плесени бледно-зеленой в центре, серо-белой – по периферии уже на 14 сутки от начала фиксации (Зайцева О.О. c соавт., 2006). Опыт был прекращен из-за плохой сохранности биологического материала.
Органы в физиологическом растворе, содержащем Hg2+, имели плотную консистенцию, бледно-коричневую окраску с розовым оттенком, крошились при механическом воздействии. На поверхности раствора наблюдали очаговый рост плесени, грязно-зеленой в центре, серо-белой по периферии тоже на 14 сутки от начала фиксации (Зайцева О.О. c соавт., 2006). Опыт был прекращен из-за плохой сохранности биологического материала.
В результате анализа фиксирующих свойств формалина и азида натрия и их профессиональной вредности установлено, что органы, пребывающие в 10 % растворе формалина чрезмерно уплотняются, издают неприятный резкий запах, имеют грязно-бурый цвет (из-за перехода гемоглобина крови в метгемоглобин) уже через 6 часов от начала консервации, а на 14 сутки заметно уменьшение размеров органов. Такой дубящий эффект объясняется изменением структуры белка тканей (Шавловский И.Э., 1898; Автандилов Г.Г., 1994; Мешандин А.Г. и соавт., 2006). Сам формалин выпадает в осадок.
По итогам экспериментов можно констатировать еще целый ряд негативных сторон формалина. Шерсть и внутренние органы опытной группы животных распространяли резкий запах формалина, у всех особей печень и почки имели окраску бледнее прижизненной. Происходило массивное выпадение пожелтевшей шерсти сразу после эвтаназии, что в сочетании с агрессивностью поведения животных свидетельствует о токсичности формалина. Дополнительно выявилось то, что объем опытного 10 % формалина за период эксперимента с крысами уменьшился с 250 мл до 100 мл, то есть произошло самопроизвольное его испарение.
Вместе с тем оценка микробиологических посевов подтвердила ранее известное антибактериальное качество 10 % формалина, что является единственным положительным качеством данного раствора (Колосов А.Е. и соавт., 1981; Платонов В.А. и соавт., 2006).
В противоположность формалину, азид натрия демонстрирует множество противоположных свойств: органы, фиксированные в 0,5 % растворе азида натрия, сохраняют прижизненный цвет, консистенцию и форму на протяжении всего периода фиксации – 15 месяцев. Причем эта процентная концентрация раствора азида натрия оптимальная, поскольку 0,05 и 0,1 % растворы не всегда обеспечивают удовлетворительную сохранность цвета и формы сохраняемых в них органов.
Еще важно также, что испарения опытного раствора азида натрия не случается; в органах, изъятых для гистологического исследования (легкие, сердце почки, печень) патологические процессы, отмеченные при формалиновой фиксации, не развиваются; а тинкториальные свойства гистологических препаратов, окрашенных гематоксилином и эозином, во все время опытов не изменяются.
Микробиологические исследования растворов азида натрия достоверно доказали отсутствие роста микроорганизмов в консерванте и на биологических образцах на протяжении всего периода опыта (550 дней).
Как видно из представленных обобщений комплексного изучения свойств формалина и азида натрия, они разительно отличаются друг от друга. Растворы азидных производных без запаха, не оказывают токсического воздействия на животных, так как являются не летучими, в отличие сильно токсичного раствора формалина. С течением времени растворы азида натрия не выпадают в осадки, не изменяют естественную окраску и форму органов и тканей, не образуют черных артефактов в гистологических препаратах. Наряду с этим солевые растворы азида натрия обладают выраженными антибактериальными свойствами, предупреждая гниение и распад анатомических композиций. При хранении анатомических препаратов в учебных заведениях бальзамирующие смеси с участием формалина надо заменять с периодичностью 2 раза в месяц, в то время как консервирующая способность солевых составов 0,5 % растворов азида натрия длится при отсутствии замены их 15 месяцев.
Влияние нелетучих растворов азидных производных и летучего формалина на живой организм в эксперименте
Экономическая эффективность и упрощение способа хранения растворов азидов перед растворами формалина как основного консерванта в настоящее время
В настоящее время на кафедре нормальной анатомии человека используется глицерин-спиртово-формоловая смесь для хранения трупного материала. Одномоментно требуется 110 литров для фиксации имеющихся учебных препаратов (без учета музейных препаратов), причем должна производиться полная замена вышеуказанных растворов 2 раза в месяц. Доказано, что консервирующая способность растворов азида натрия не теряется при отсутствии замены растворов в течение 7 месяцев (Зайцева О.О. c соавт., 2006). По имеющимся последним данным, 1 литр 37 % раствора формальдегида стоит 32 рубля, 1 литр 70° спирта – 50 рублей, 1 литр глицерина – 180 рублей. Соотношения между растворами таковы, что на 10 литров воды берется 5 литров глицерина, 5 литров спирта, 400 мл формальдегида, 50 г салициловой кислоты и 1 кг поваренной соли, т.е. требуется около 132 тысяч рублей, чтобы приготовить 110 литров смеси. В год затраты составят 3 миллиона 168 тысяч рублей. Один литр солевого раствора азида натрия стоит 1 рубль 80 копеек. В год затраты составят 4 тысячи 752 рубля. Стоимость одного килограмма сухого вещества – 600 рублей. С точки зрения экономической выгоды: 1 литр азида натрия дешевле в 17 раз 1 литра 37 % раствора формальдегида, в 27 раз дешевле 1 литра 700 спирта и в 100 раз дешевле 1 литра глицерина. Азид натрия может храниться и транспортироваться также в сухом виде, в пластиковой, полиэтиленовой или стеклянной таре без температурных ограничений (его температура плавления 275 °С). Единственным условием, которое необходимо соблюдать, является недопустимость нахождения вблизи азида натрия растворов сильнодействующих кислот (соляной, серной) во избежание образования взрывчатого компонента (Неницеску К., 1968). Сами по себе солевые растворы азида натрия абсолютно не летучи, в чем их огромное преимущество. Растворы формальдегида могут храниться в защищающих от света темных склянках при температуре не ниже 90 °С (Уокер Д.Ф., 1957). При более сильном охлаждении в растворе появляется муть, которая постепенно оседает в виде белого осадка (параформальдегид и триоксиметилен); то же происходит и при испарении. Под влиянием света появляется муравьиная кислота в формалине (Ромейс Б., 1954).
В практическом аспекте полученные нами данные позволят широко использовать солевые растворы азида натрия в качестве консервантов музейного и учебного материала, крупных биологических объектов в прозекторских и отделениях судебно-медицинской экспертизы, в системе МЧС. Также возможна полная замена летучих растворов формальдегида и дорогостоящих компонентов фиксирующих смесей и решение проблемы конверсии данного вещества в мирное время в оборонной промышленности, где азиды широко применяются.
Несмотря на большое количество работ, посвященных бальзамированию целых трупов и консервации отдельных органов (Привес М.Г., 1955, 1956, 1959, 1966, Ярославцев Б.М., 1961, Ратневский А.Н., 1972, Асфондияров Р.И. и соавт., 1974, Лопухин Ю.М., 1975, Авдеев М.И., 1976, Атласов Н.И., 1981, Донцов Ю.Г., 1982, Williams T.M. et al., 1984, Гайворонский И.В. и соавт., 1984, Лавриненко В.С. и соавт., 1985, Власов В.Б. и соавт., 1987, Бектемирова Р.М. и соавт., 1990, Сергеева Н.А. и соавт., 1991, Каспаров А.А. и соавт., 1993, Хаджиматов Г.М. и соавт., 1993, Автандилов Г.Г., 1994,.Каспарьянц С.И. и соавт., 1995, Фадеев С.П., 1995, 1996, 1997, 1998, Гедыгушев И.А. и соавт., 1997, Збарский И.Б. и соавт., 1998, Баринов Е.Х. и соавт., 1999, Кузнецов Л.Е., и соавт., 1996, 1999, Бекемайер Р., 2000, Касьянов Г.И., 2000, Воробьев В.П., 2003), проблема сохранения биологического материала еще далека от своего окончательного разрешения.
Степень повреждения макро- и микроструктуры клеток тканей фиксируемых органов в растворе формалина в первую очередь определяется присоединением его к аминогруппам белков, что вызывает их денатурацию.
Известно, через 6 часов после погружения органа в формальдегидный раствор возникает изменение окраски тканей, так как гемоглобин крови переходит в метгемоглобин, вследствие чего прижизненный цвет органа становится грязно-бурым (Минаков П.А., 1897). Ткани трупов, зафиксированные формалином, теряют свою подвижность и эластичность, трупы, зафиксированные 10-15 % раствором формалина, быстро сохнут и мумифицируются вследствие сильного дубящего эффекта (Шавловский И.Э., 1898). Именно из-за наличия у формалина этого свойства, он является идеальным консервантом для гистологических препаратов с достаточной сохранностью ультраструктуры клеток на длительный период времени (Зявлов В.И., 1981). Чем выше процентное содержание формалина в растворе (15-20 %), тем сильнее фиксируется поверхность органа с образованием корки, мешающей доступу формалина в глубину тканей, где и начинается гниение (Барт В.И., 1904).
Бактерицидность формалина настолько велика, что споры сибирской язвы гибнут в 3 %-ном растворе формалина через 10 минут. Бульон, разведенный формалином в пропорции 1:1200, остается стерильным в течение многих недель (Неницеску К., 1968).
Кроме того, формалин летуч, имеет резкий запах, его пары вызывают раздражение слизистых оболочек, сухость и царапающий рефлекс в горле. При длительном нахождении в его парах появляются головные боли и раздражительность, бледность кожных покровов, симптом «ватных» ног (Уокер Д.Ф., 1957).
Поэтому при работе с растворами формалина возникают значительные изменения в состоянии здоровья человека, особенно, если стаж взаимодействия его с парами формалина превышает 10 лет (Бектемирова Р.М., Меркурьева Р.В., 1990).
Условия хранения формалина довольно определенные и не самые выгодные. На небольшом морозе формалин замерзает и выпадает в белый осадок (формальдегид). Поэтому его нужно хранить при температуре не ниже 9 °С в темных склянках [1, 3, 4].
С нашей точки зрения, оптимальное сохранение трупного материала должен обеспечивать консервант, не изменяющий структуру белка, а обладающий способностью ингибировать ферментную активность протеаз не только клеток консервируемых объектов для предотвращения аутолиза, но и ферментных систем микроорганизмов для предупреждения бактериальной инвазии (Глинка Н.Л., 1980).
При рассмотрении данной задачи с такой точки зрения появляется неочевидный путь ее решения – ингибирование ферментных систем микроорганизмов и самих ферментов. Такими консервантами являются абсолютно нелетучие растворы азидных производных, неорганических соединений азота, в солевых растворах.
В результате проведенных исследований нами установлено, что азидные производные обладают прекрасными консервирующими способностями с полным сохранением макроскопической структуры и формы органов, прижизненной окраски в течение длительного срока фиксации [3, 4].
Кроме того, солевые растворы азида натрия различной процентной концентрации не летучи, что является очевидным из опытов, проведенных на лабораторных животных (Зайцева О.О. с соавт., 2006).
При непосредственном контакте с кожей рук азид натрия не оказывает дубящего эффекта, но, с другой стороны, это отрицательно сказывается на сохранности ультраструктуры гистологических препаратов в течение длительных сроков фиксации (60 суток) (Зайцева О.О. с соавт., 2006).
При оценке антибактериальной способности азида натрия учитывали рост микроорганизмов, которые в первые часы после наступления смерти вызывают гнилостное разложение тканей: кишечная палочка, протей, золотистый стафилококк. Исходя из данных микробиологических посевов, азиды натрия обладают сильными дезинфицирующими свойствами, особенно 0,3 и 0,5 % растворы неорганических производных азота [3, 4] (приложения).
Учитывая материальные затраты на проведение экспериментальных исследований, мы доказали экономическую эффективность растворов азида натрия перед другими, наиболее часто используемыми, консервирующими растворами (глицерин – спиртово-формоловый). 1 л азида натрия дешевле в 17 раз 1 л 37 % раствора формальдегида, в 27 раз дешевле 1 л 700 спирта и в 100 раз дешевле 1 л глицерина (Мешандин А.Г. и соавт., 2006).
Единственным условием, которое необходимо соблюдать при хранении азидных производных, является недопустимость нахождения вблизи азида натрия растворов сильнодействующих кислот (соляной, серной) во избежание образования взрывчатого компонента (Неницеску К., 1968).
Изучаемая эффективность азидных производных для консервации крупных биологических объектов позволит провести полную замену формалина и его производных, значительно улучшит качество и продлит время хранения учебного и музейного материала на кафедрах нормальной и патологической анатомии, а также практическом здравоохранении, патолого-анатомических отделениях, бюро судебно-медицинской экспертизы, служб МЧС.
Использование новых технологий консервации биологического материала приведут к уменьшению токсического воздействия формалина на персонал вышеупомянутых кафедр и прозекторских. В результате этого улучшится качество труда и снизится степень возникновения последствий работы с формалином.
Как показало анатомическое исследование для длительного и качественного хранения органов и тканей не требуется замена растворов азидных производных [3], в то время как полная замена растворов формалина должна производиться 2 раза в месяц [3].
На основе полученных положительных результатов о сохранении биологических объектов предложен эффективный, доступный и надежный фиксатор трупного материала (Мешандин А.Г. с соавт., 2006).
1. О развитии студенческого самоуправления в РФ. Приказ Минобразования РФ №15-52-486/15-01-21 от 2.10.2002 г.
2. Гессен С.И. Основы педагогики. Введение в прикладную философию.- М., 1995. – С. 122-126.
3. Зайцева О.О., Ашихмин С.П., Жданова О.Б. с соавт. Новый способ консервации биоматериала // Сб. ст. Междунар. научно-практ. конф. ГНУ ВНИИОЗ РАСХН. – Киров. – 2007. –
С. 161-163.