при высокой температуре белки птичьего яйца постепенно
Изменение белков яиц при тепловой обработке
Яйца содержат 12,7% полноценных белков: овоальбумин, кональбумин, овомукоид, авидин, лизоцим, овоглобулин, в желтке – фосфопротеиды. Процесс денатурации: 50-55ºС– местные помутнение белка, 55-60ºС – помутнение распространяется на весь белок, 60-65ºС – белок густеет, 65-75ºС – образуется студнеобразная масса, 75-85ºС – студень уплотняется, 85-95ºС – образование плотного студня. Желток загустевает только при 70ºС. При разведении яиц молоком или водой образуются более нежные студни, оптимальным является 50-60% жидкости. Соль снижает температуру денатурации, поэтому при изготовлении яичницы, если крупинки соли попадают на желток, образуются пятна (свернувшийся белок), поэтому солят только белок.
Белки сырого яйца плохо перевариваются организмом (авидин связывает витамин Н, овомукоид угнетает действие фермента трипсина) и частично всасываются непереваренными, вызывая аллергию и ухудшая усвоение других компонентов пищи. Тепловая обработка улучшает перевариваемость белков яиц, причем яйца сваренные всмятку перевариваются лучше, чем вкрутую. Желтая окраска желтка обусловлена присутствием каротиноидов, при длительной варке поверхностный слой темнеет вследствие того, что серосодержащие аминокислоты при нагревании отщепляют сероводород, который взаимодействует с соединениями железа, образуя темноокрашенные сульфиды. Уменьшить потемнение поверхности желтка возможно, погрузив его на несколько секунд в холодную воду, при этом давление воздуха под скорлупой снижается и сероводород диффундирует к поверхности.
Строение, физико-химические изменения овощей при
Тепловой обработке
Овощи состоят из трех тканей: покровной (эпидермис), паренхимной, проводящей. Съедобная часть представлена в основном паренхимной тканью. Паренхимная ткань состоит из тонкостенных клеток, соединенных прослойками срединных пластинок, придающих овощам механическую прочность. Содержимое отдельных растительных клеток представляет собой полужидкую массу – цитоплазму, в которую погружены различные клеточные элементы: вакуоли, ядра, пластиды и др. В состав клеточных стенок входят: клетчатка (целлюлоза), полуклетчатка (гемицеллюлоза), протопектин, пектин и соединительнотканный белок экстенсин. В срединных пластинках преобладает протопектин. Изменения, происходящие при тепловой обработке овощей:
1. Размягчение обусловлено распадом протопектина и экстенсина, клетчатка при тепловой обработке не изменяется, волокна гемицеллюлоз набухают. Протопектин является полимером пектина, связующими звеньями которого являются солевые мостики из двухвалентных ионов кальция и магния. При тепловой обработке происходит ионообменная реакция: ионы кальция и магния заменяются одновалентными ионами натрия и калия, при этом полимерная связь разрушается и образуется растворимый в воде пектин и овощная ткань размягчается. Однако реакция эта обратима, поэтому необходимо удалять ионы кальция из сферы реакции. В растительных продуктах содержатся вещества (фитин), способствующие удалению ионов кальция из сферы реакции. Однако связывание ионов кальция и магния не происходит в кислой среде, поэтому размягчение овощей замедляется. Известно, что если при изготовлении щей и борщей из квашенной капусты картофель заложить одновременно с капустой или позже, то он остается жестковатым. В разных овощах скорость распада протопектина неодинакова, поэтому варить можно все овощи, а жарить только те, в которых протопектин успевает превратиться в пектин, пока вся влага не испарилась (картофель, кабачки, помидоры и др.). Размягчение овощей связано также с деструкцией (распадом) белка – экстенсина с образованием растворимых продуктов. В тканях картофеля при протирании в горячем и остывшем состоянии происходят следующие изменения: в горячем картофеле оболочки паренхимной ткани обладают прочностью и эластичностью, поэтому не разрушаются при протирании, даже если и происходит частичное разрушение клеточных стенок, то это не сопровождается разрушением клейстеризованных зерен крахмала и выходом их содержимого наружу. При охлаждении вареного картофеля эластичность клеточных стенок понижается, а хрупкость возрастает. При механическом воздействии разрушаются клетки и зерна клейстеризованного крахмала, вытекающий клейстер придает пюре клейкость.
2. Изменение витаминов при тепловой обработке овощей. Наиболее устойчивы к действию высоких температур каротины, витамины группы В частично переходят в отвар и частично разрушаются. Значительным изменениям подвергается витамин С, который частично разрушается и переходит в отвар. Степень разрушения витамина С зависит от многих факторов: скорости нагрева, длительности обработки, контакта с кислородом воздуха и др. Чем быстрее нагреваются овощи при варке, тем меньше разрушается витамина С, при варке картофеля с погружением его в холодную воду разрушается 35% витамина С, в горячую – всего 7%. Варка овощей дольше сроков, предусмотренных технологией, приводит к значительным разрушениям витамина С. Разрушение витамина С происходит при длительном хранении вареных овощей. За 3 ч хранения вареных овощей в остывшем состоянии может разрушиться до 20-30% витамина С, после суточного хранения в овощах остается только около половины его первоначального содержания.
Потери витамина С в зависимости от способа тепловой обработки: наибольшие потери при варке в воде, (до 49%), меньше потери при варке на пару (38%), при припускании витамин С разрушается больше, чем при варке, поскольку овощи находятся в паровоздушной среде в присутствии кислорода воздуха, который ускоряет окисление. При обработке овощей в поле СВЧ сохранность витамина С больше, поскольку происходит быстрый прогрев и сокращаются сроки тепловой обработки. При жарке потери витамина С меньше, чем при варке и припускании, поскольку продукт обволакивается жиром и предохраняет их от соприкосновения с кислородом воздуха. При изготовлении изделий из овощной котлетной массы, когда тепловое воздействие чередуется с механическим потери витамина С достигают 90% и более. Таким образом, чтобы сохранить в овощных блюдах как можно больше витамина С, необходимо строго соблюдать технологические режимы тепловой обработки.
Лекция №5
Тема «Физико-химические изменения липидов при кулинарной
обработке продуктов: плавление, эмульгирование, гидролиз»
План
1. Липиды (жиры и масла): физиологическое значение, химическое строение и состав.
2. Физические и химические свойства жиров.
3. Физико-химические изменения жиров при варке продуктов: плавление, эмульгирование, гидролиз.
1. Липиды: физиологическое значение, химическое строение
И состав
Липидами (от греч. lipos – жир) называют сложную смесь органических соединений с близкими физико-химическим свойствами, которая содержится в растениях, животных, микроорганизмах. Липиды делят на две основные группы: простые и сложные липиды. К простым липидам (не содержащим атомов азота, фосфора и серы) относятся производные высших жирных кислот и спиртов. Молекулы сложных липидов содержат в своем составе фосфорную и серную кислоты. Наиболее важная и распространенная группа простых нейтральных липидов – ацилглицерины – сложные эфиры глицерина и высших карбоновых кислот. И, по-существу, именно их называют жирами или маслами, так как они составляют 95% липидов.
Липиды играют очень важную роль в питании человека, являются поставщиком энергии, жирорастворимых витаминов, полиненасыщенных жирных кислот (витамины F), выполняют пластическую функцию. Теория сбалансированного питания рекомендует, чтобы общее количество жиров в суточном рационе составило 80-120 г, из них 20-30% – жиры животного происхождения, остальное – растительного происхождения.
Жиры по химической природе являются сложными эфирами трехатомного спирта глицерина и жирных кислот. Глицерин является постоянным элементом любого жира. Жирные кислоты могут быть насыщенными (двойная связь между атомами углерода отсутствует – масляная кислота, пальмитиновая, стеариновая и др.) и ненасыщенными (с одной или несколькими двойными связями – олеиновая, линолевая, линоленовая, имеющие большое физиологическое значение). От соотношения в жире насыщенных и ненасыщенных жирных кислот зависит консистенция жира: жидкие жиры богаты ненасыщенными жирными кислотами, если в жирах преобладают насыщенные кислоты, то такой жир при комнатной температуре остается твердым.
В природных жирах в большинстве содержатся триглицериды – эфиры трехатомного спирта глицерина, когда в молекуле глицерина этерифицированы все три ОН-группы. Очень редко триглицериды содержат остатки какой-либо одной кислоты. Как правило, они состоят из смешанных или разнокислотных триглицеридов.
Биологическая ценность жиров определяется соотношением в них насыщенных и ненасыщенных жирных кислот: растительные жиры обладают большей биологической ценностью. Потребность организма в полиненасыщенных жирных кислотах составляет 1% от суточной калорийности, она обеспечивается 20-30 г растительного масла в день.
В технологических процессах жиры являются составной частью многих кулинарных изделий, а также выполняют роль теплопередающей среды при жарке изделий.
В этом посте мы узнаем про то, как температурный режим влияет на яйца, а так же, как они взаимодействуют с различными ингредиентами. Как и для чего нам нужны эти знания на практике, я расскажу в следующих постах.
Яйца, протеины и температура
Не существует продукта способного более радикально меняться под воздействием внешних раздражителей, чем яйца. Из жидкого вещества, мы получаем продукт, который можно резать ножом. Благодаря этому качеству, яйца дают нам возможность готовить из них разнообразные блюда!
Яйца обязаны этому «умению» содержащимся в них протеинах, и способности протеинов “сцепляться” друг с другом.
Изначально желток и белок жидкие, потому что они представляют из себя «мешочки» воды, содержащие в себе молекулы протеинов. При этом молекулы воды преобладают над молекулами протеинов в 1000 раз. Протеины в сыром яйце существуют отдельно друг от друга, т.е. еще не “сцеплены” Когда мы нагреваем яйцо, все его молекулы начинают двигаться быстрее, сталкиваться с друг другом чаще, и протеины ”сцепляться” друг с другом. При этом в яйце остается много молекул воды, но они уже не могут двигаться свободно. Это мое очень упрощенное объяснение. Не буду никого утомлять физикой и химией процесса, тем более, что я сама не сильна. Но, здесь нам важно понимать, что нагревание яйца приводит к “сцеплению” протеинов, и как следствие к затвердеванию яйца. И чем сильнее мы подвергаем яйца воздействию тепла, тем тверже они становятся.
Яйца также крепнут от консервирования в кислоте или соли, и от взбивания. Все эти действия заставляют протеины сцепляться.
Отсюда, думаю возникло правило дать яйцам полежать час при комнатной температуре перед взбиванием. Протеины будут сцепляться лучше, и их будет легче взбить.
При тепловой обработке яиц при приготовлении практически всех блюд, мы стремимся получить нежную и сочную текстуру. Если мы переусердствуем с тепловой обработкой, то получим либо нечто резиновое, либо комки яйца и отделившуюся жидкость. Почему это происходит? Потому что излишнее нагревание сцепляет протеины белков слишком сильно и выталкивает из них воду. Поэтому вареные или жареные яйца теряют жидкость в виде пара и становятся резиновыми, в то время как смеси яиц и других жидкостей расслаиваются на две фазы: жидкость и твердые комки протеина.
Следует отметить, что точная температура будет зависеть от ингредиентов, которые вы добавляете к яйцам. Ничем не разбавленные яйца коагулируют при достаточно низкой температуре. Белок загустевает при 63 ºC и становится твердым при 65 ºC градусах. В прошлом посте я рассказывала, что ответствен за это Оватрансферрин. Желток начинает загустевать при 65 ºC, и твердеет при 73 ºC.
Воздействие других ингредиентов
Мы часто смешиваем яйца с другими ингредиентами, например, при приготовлении различных блюд из яиц мы часто добавляем соль, лимонный сок, сахар, сливки, молоко, бренди и т.д. Любая такая добавка влияет на процесс коагуляции протеинов яйца, что в свою очередь отражается на консистенции блюда и, как следствие, отражается на качестве конечного продукта
Молоко, Сливки, Сахар – растворяют, замедляют, добавляют нежность
Когда мы разбавляем яйца другой жидкостью, мы повышаем температуру, при которой начинается загустевание. Благодаря растворению, молекулы протеина окружаются большим количеством молекул воды, и протеины нужно нагреть сильнее, чтобы они задвигались быстрее и соединились с друг другом. Сахар таким же образом повышает температуру загустевания. Столовая ложка сахара окружает каждую молекулу протеинов яйца экраном тысячи молекул сахарозы. Например, заварной крем, содержащий одно яйцо, чашку молока, и одну столовую ложку сахара начинает загустевать при 78-80 ºC. При этом объем протеинов увеличивается благодаря гораздо большему количеству жидкости (18-20 ст. л. жидкости). Коагулянт становится гораздо более «хрупкий» и может легко нарушиться при дальнейшем нагревании. С другой стороны, при приготовлении Эггнога (напиток на основе взбитых яиц с добавлением молока, коньяка или рома, сахара, специй) протеины яйца растворяются настолько, что не могут вместить всю жидкость и при этом ”сцепиться ” друг с другом, и поэтому яйца просто делают текстуру напитка более вязкой.
Утверждение, что соль и кислота делают яичные протеины более твердыми, является заблуждением. Хоть они и ускоряют сближение протеинов, они не дают протеинам сблизиться слишком сильно. То есть они понижают температуру коагуляции, но приводят к более нежной текстуре.
Повара знают этот секрет давно. Например, Паула Волферт (Paula Wolfert) описывала взбивание яиц с лимонным соком перед длительной тепловой обработкой. Благодаря такому методу взбивания, яйца становятся менее жесткими при приготовлении. Моя любимая Клаудиа Роден (Claudia Roden) дает арабский рецепт яичницы болтуньи. При помощи уксуса она достигает очень нежной текстуры.
Вывод:
1. Чрезмерное тепловое воздействие приводит к тому, что яйца становятся слишком жесткими.
2. Добавление различных жидкостей повышает температуру коагуляции, и увеличивает время приготовления блюд.
3. Соль и кислоты добавляют блюдам из яиц нежности.
Как применять эти знания на практике я расскажу в следующих постах.
Как жар убивает клетки
При превышении определённой температуры клетка приходит в негодность и умирает. Одно из простейших объяснений такой непереносимости жары состоит в том, что необходимые для жизни белки – те, что извлекают энергию из еды или солнечного света, обороняются от вторжений, уничтожают отходы и т.п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
Теперь же биофизики из Швейцарской высшей технической школы Цюриха изучили поведение каждого белка в клетках четырёх различных организмов при повышении температуры. Это исследование и богатый набор собранных данных, опубликованный в журнале Science, показали, что при температуре, достаточной для смерти клетки – человеческой, или же клетки кишечной палочки Escherichia coli – разрушаются лишь несколько ключевых белков. Более того, обилие белков в клетках оказалось неожиданным образом связанным с их стабильностью. Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Паола Пикотти, биофизик, руководивший работой, объяснила, что эксперименты отталкивались от старых и нерешённых вопросов: почему некоторые клетки выживают при высоких температурах, а другие – умирают? Бактерия Thermus thermophilus счастливо живёт в горячих источниках и в домашних нагревателях [при оптимальной температуре в 65 °C – прим. перев.], тогда как клетки E. coli чахнут при температурах выше 40 °C. Убедительные доказательства говорят о том, что дело тут в разной стабильности белков этих организмов. Но следить за белком, находящимся в живой клетке, что было бы идеальным методом изучения, очень неудобно. Изолирование белка в пробирке не даёт всех ответов, поскольку внутри организма белки сбиваются вместе и влияют на химию друг друга, или же поддерживают друг друга в необходимой форме. Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Как тепло уничтожает белки

1) Первичная структура белков – это длинные цепочки аминокислот, объединённые в заданные генами последовательности.
2) Вторичная структура – это аминокислота, которая также свёртывается в конфигурации, удерживаемые слабыми межмолекулярными связями.
3) Третичная структура – слабые связи, стабилизирующие расположение прямых и скрученных участков трёхмерной структуры белка. Их расположение позволяет белку соединяться с нужными молекулами.
Чтобы решить поставленную задачу, команда разработала автоматизированную процедуру наблюдения. Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], биолог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Во время наблюдений было ясно видно, что белки всех живых существ не разворачиваются все сразу при повышении температуры. «Мы увидели, что лишь небольшое подмножество белков разрушилось на самых ранних стадиях, – сказала Пикотти, – и это были ключевые белки». На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
Этот парадокс – самые важные белки оказываются самыми хрупкими – может быть отражением того, как эволюция создала их для выполнения соответствующих задач. Если у белка есть множество ролей, его нестабильность и склонность к разворачиванию и повторному сворачиванию может стать преимуществом, поскольку она может позволить ему принимать разные формы, подходящие к разным задачам. «Многие из этих ключевых белков обладают большой гибкостью, что и делает их менее стабильными», но при этом наделяет их способностью связываться с различными целевыми молекулами в клетке, пояснила Пикотти. «Скорее всего, именно так они справляются со своими функциями. Это некий компромисс».
Тщательнее изучив E. coli, для которой собранные данные получились наиболее качественными, исследователи обнаружили и связь между обилием белка – количеством его копий в клетке – и его стабильностью. Чем больше копий белка делает клетка, тем больше температура требуется для его уничтожения. При этом оказывается, что большое количество копий не коррелирует с критичностью белка для выживания. Некоторые ключевые белки встречаются очень редко. Эта связь между обилием и надёжностью подтверждает идею, выдвинутую Драммонд ещё лет десять назад – у клеточной системы, изготавливающей белки, есть тенденция к тому, чтобы периодически допускать ошибки. Ошибка обычно дестабилизирует белок. Если этот белок оказывается распространённым, и такой белок в клетке появляется сотню или тысячу раз в день, тогда неправильно свернувшиеся копии, произведённые в больших количествах, могут засорить клетку. Таким образом организму выгодно было бы эволюционировать так, чтобы наиболее распространённые белки были бы и наиболее стабильными, что подтверждают полученные командой Пикотти данные.
Чтобы понять, какие качества белка делают его стабильным, исследователи сравнили данные E. coli и T. Thermophilus. Белки E. coli начали разваливаться при 40 °C, и практически полностью деградировали при 70 °C. Но при этой температуре белки T. thermophilus только начинали испытывать дискомфорт – некоторые из них держали форму и при 90 °C. Команда обнаружила, что у T. thermophilus белки обычно были короче, и некоторые типы форм и компонентов белка чаще встречались в самых стабильных из них.
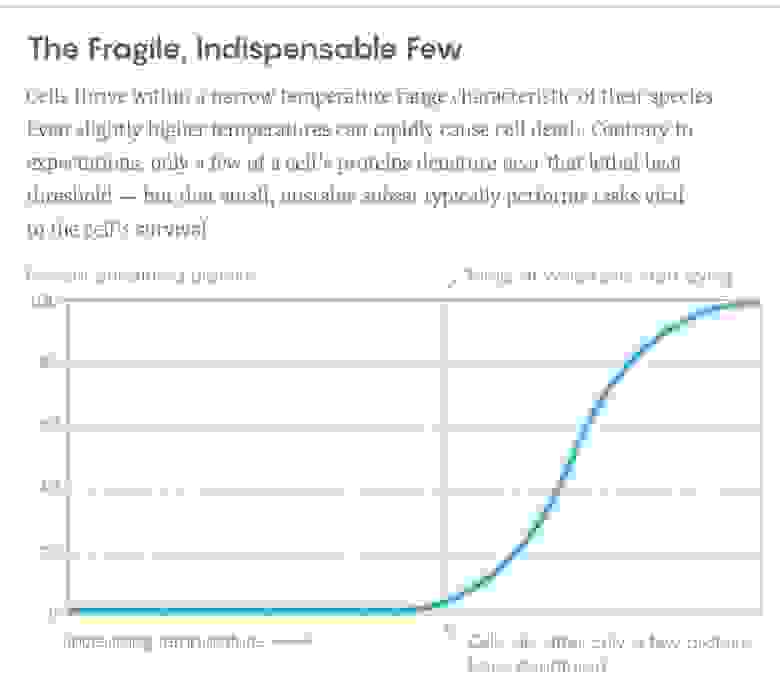
Пример кривой из эксперимента. По вертикали – процент развернувшихся белков, по горизонтали – температура. Вертикальная черта – температура, при которой клетки начинают умирать. Для этого нужно развернуться всего нескольким ключевым белкам.
Открытия могут помочь исследователям разработать белки, чья стабильность подстроена под их задачи. Во многих промышленных процессах, где используются бактерии, повышение температуры повышает и отдачу – но довольно скоро бактерии начинают умирать от жары. Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Обилие информации по поводу того, насколько легко разворачиваются определённые белки, сильно порадовало некоторых биологов. От стабильности белка напрямую зависит вероятность его агрегации: появления комков неразвернувшихся белков, прилипающих друг к другу. Агрегаты белков могут обернуться кошмаром для клеток и мешать выполнению главных задач. К примеру, их обвиняют в появлении некоторых серьёзных неврологических проблем, таких, как болезнь Альцгеймера, при которой бляшки развернувшихся белков засоряют мозг.

Паола Пикотти
Но это не значит, что агрегация происходит только у организмов, страдающих определёнными заболеваниями. Наоборот, исследователи поняли, что возможно, она происходит постоянно, и что у здоровых клеток есть методы, при помощи которых они справляются с нею. «Я думаю, что всё чаще это явление признаётся очень распространённым», – сказал Микель Вендрусколо [Michele Vendruscolo], биохимик из Кембриджского университета. «Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
И хотя многие учёные интересуются агрегатами из-за наносимого ими ущерба, некоторые смотрят на это явление с другой точки зрения. Драммонд говорит, что становится ясным, что некоторые агрегаты – это не просто кусочки мусора, болтающиеся в клетке. Они содержат активные белки, продолжающие выполнять свои функции.
Представьте, что вы издалека видите дым, поднимающийся из какого-либо здания, говорит Драммонд. Вокруг здания вы видите некие фигуры, и вы представляете себе, что это тела, извлечённые из руин. Но если вы подойдёте ближе, вы можете обнаружить, что это живые люди, спасшиеся из горящего здания, ждущие, пока происшествие закончится. Так получается с исследованием агрегатов, говорит Драммонд: исследователи обнаруживают, что белки в агрегатах оказываются не жертвами, а выжившими. «Сейчас вообще появляется новая область науки, растущая взрывными темпами», – говорит он.
Комкование белков может оказаться не признаком повреждений, а способом для белка сохранять свои функции в сложной ситуации. Оно может, к примеру, защищать их от окружающей среды. А когда условия улучшаются, белки могут покидать агрегаты и сворачиваться заново. «Их форма меняется в зависимости от температуры таким образом, что на первый взгляд это кажется неправильным сворачиванием, – говорит Драммонд. – Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
В общем и целом, работа утверждает, что белки – удивительно динамичные структуры. Сначала они могут показаться жёсткими машинами, работающими над зафиксированными задачами, для которых подходит одна определённая форма. Но на самом деле белки могут принимать несколько различных форм во время своей нормальной работы. И в нужное время их форма может меняться так сильно, что может показаться, будто они портятся, хотя на самом деле они наоборот укрепляются. На молекулярном уровне жизнь может представлять собой постоянные соединения и разъединения связей.