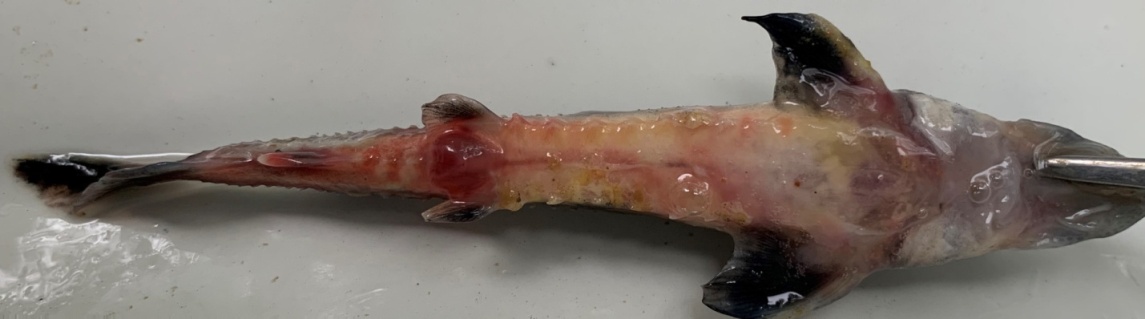
болезни осетровых рыб таблица
Лечение осетровых рыб
Осетровые (Acipenseridae) – это самые знаменитые представители водной мировой фауны и один из ценнейших продуктов питания человека. По месту обитания они подразделяются на проходные, полупроходные и пресноводные. В связи с повсеместным запретом отлова осетровых рыб их продажа базируется на промышленном выращивании в рыбных хозяйствах.
Содержание:
Семейство осетровых
Представители семейства: осетр, белуга, лопатоносы и лжелопатоносы – имеют удлиненное рыло, хорошо развитые ноздри и цилиндрический беззубый рот. Продолговатое веретенообразное тело гладкое или покрытое продольно расположенными костными пластинками. Длина взрослых особей, например белуги, может достигать 5 метров, масса – от 8,5 кг до 1,5 тонн. Самцы большинства осетровых становятся половозрелыми в 5 – 9 лет, самки – в 8 – 12 лет. Питаются растительным и животным бентосом, взрослые крупные особи – мелкими беспозвоночными и рыбой. Наиболее ценными являются представители двух родов: осетры и белуги.
Отличительные родовые признаки
Белуга (Huso huso, huso dauricus Georgi)
Самая крупная пресноводная рыба, обитающая в бассейнах Черного, Азовского, Каспийского и Средиземного морей. Взрослые особи имеют характерную, соединяющую жабры перепонку и уменьшенный первый шип спинного ряда. Образ жизни белуги существенно отличается от других осетровых. Этот род имеет 2 формы: озимую и яровую. Озимая выходит из моря осенью, яровая – ранней весной. В период нереста поднимается высоко вверх по рекам. Размножение происходит 1 раз в 2–3 года. Из-за чрезмерного сокращения популяции белуга находится на грани исчезновения. После занесения в Красную книгу отлов рыбы разрешен только при наличии лицензии и преимущественно в научно-исследовательских целях.
Осетры (Asipencer)
Проходные и пресноводные рыбы, уступающие белугам размерами и отличающиеся перепонкой, приращенной к межжаберному промежутку. Род насчитывает 17 видов, большинство из которых обитает в Черном, Азовском и Каспийском морях. Осетр ведет придонный образ жизни. В весенне-летний период выходит в реки для метания икры. Нерестится очень далеко от устья. Взрослые особи откладывают от 60 до 800 тыс. икринок. Они приклеиваются к субстрату или развиваются между камнями. В связи со стремительным уменьшением популяции применяется бассейновый метод выращивания молоди, на специализированных осетровых заводах.
Виды заболеваний и способы лечения
Паразитарные болезни
У популяций, обитающих в естественных водоемах и выращиваемых в рыбных хозяйствах, отмечается достаточно низкий риск инвазирования. Однако массовое заражение особи может нанести существенный вред рыбе. Лечение осетровых рыб, зараженных паразитами, основано на использовании ветеринарных препаратов, специализированных для лечения рыб. Наибольшее эпизоотическое значение для осетровых представляют следующие виды экзопаразитов:
Грибковые заболевания
Осетрообразные восприимчивы к заражению водными плесневыми грибками Saprolegniacea, вызывающими сапролегниоз. Болезнь проявляется пушистым «ватным» налетом на коже, разрушением и омертвлением мягких тканей, поражением внутренних органов и развитием общего микотоксикоза. После проведения санитарных мероприятий большинство особей выздоравливают и только самые ослабленные погибают. При лечении осетровых рыб, зараженных грибком, используют солевые ванны.
Бактериальные инфекции
Вирусные инфекции
Большинство вирусных заболеваний связано со стресс-факторами (недостаток кислорода, нарушение температурного режима, изменение состава воды, повышенная плотность посадки). Самые агрессивные возбудители: аденовирус, иридовирус, герпес-вирусы 1-го и 2-го типов.
Возбудитель — ДНК-вирус, поражающий эпителий слизистой оболочки кишечника и спирального клапана. В основном заболеванию подвергается молодь осетровых рыб массой 0,5–10 г. Пораженные особи выглядят апатичными, истощенными. Характерным признаком также может служить изменение формы головы: она напоминает булавочную головку. В кишечнике такой рыбы нет пищеварительных масс, также у нее бледнеет печень, развивается жировая дистрофия. Смертность может достигать 50 %.
Возбудитель — ДНК-вирус, поражающий эпителий (кожу, жабры, верхний отдел пищеварения). Клетки эпителия разрастаются, впоследствии начинается некроз тканей. Как правило, заболевание встречается у молоди белого и озерного осетров в возрасте 3–16 дней и 9–12 месяцев.
Вирусное поражение локализуется в клетках кожи, ротовой полости и жабр. Чаще всего болезнь диагностируют у молоди в возрасте до 4 месяцев. Сибирский осетр более устойчив к заболеванию. Характерные симптомы заболевания: вялость и апатия у рыб, отказ от корма, выраженная бледность окраса, кровоизлияния на жабрах. Еще один признак – больная рыба плавает хвостом вниз. Смертность может достигать 50 %.
Вызывается ДНК-содержащим герпесвирусом. Поражает эпидермис кожи и слизистых оболочек в области губ. Чаще всего болеет молодь осетра массой менее 13 г. При разведении в бассейне симптомы у больной рыбы могут никак не проявляться. Дикий осетр, заразившийся герпесвирусом-1, перестает есть, становится вялым, в его желудке начинает накапливаться экссудат.
Также является разновидностью ДНК-содержащего герпесвируса, который поражает губы, рострум, грудные плавники и внутренние органы рыбы (селезенку, почки, печень). Заболеванию подвержена как молодь, так и взрослые особи.
Лечение при вирусных заболеваниях. Специалисты АВЗ рекомендуют использовать «Антибак», который хотя и не убивает вирус, но облегчает течение болезни, так как подавляет вторичную бактериальную инфекцию. Профилактика заключается в соблюдении условий содержания рыбы.
Болезни осетровых рыб таблица
ВЫЯВЛЕНИЕ ЭКТОПАРАЗИТОВ МОЛОДИ ОСЕТРОВ ПРИ БАССЕЙНОВОМ ВЫРАЩИВАНИИ
Автор работы награжден дипломом победителя II степени
Разведение осетров – важное направление в рыбоводстве, так как осетры это почти реликтовые, очень древние рыбы, численность которых резко сокращается в естественных водоемах из-за браконьерства, загрязнения окружающей среды, снижения мест естественных нерестилищ и других многих факторов среды. Одним из путей восстановления биоресурсов осетровых является их заводское воспроизводство.
Осетры относятся к костно-хрящевым рыбам, поэтому ценятся в кулинарии, так как очень питательны и быстро готовятся. Но несмотря на повышенный покупательский спрос на осетров, в магазинах розничной торговли редко продается свежий осетр. Поэтому искусственное воспроизводство осетровых очень актуально.
Летом 2018 года в составе ученической группы экологического клуба «Аквацентр» МОУ Рыбненской сош я на биологической практике посещала частное предприятие ООО «Селекцентр», которое занимается подращиванием молоди сибирского осетра с целью ее дальнейшей продажи в рыбхозы. Меня очень заинтересовала организация выращивания осетров в приспособленных условиях. Я стала посещать модуль по выращиванию осетров и заметила, что в бассейнах ежедневно бывает несколько мертвых мальков. Из рыбоводной литературы я узнала, что это неизбежно при выращивании осетров в искусственной среде, но количество отхода росло с каждым днем. Рыба явно болела и потом погибала.
Проблема исследования: почему при выращивании молоди осетров в бассейнах наблюдается отход?
Цель: выяснить причины гибели молоди осетров при выращивании в бассейнах.
Гипотеза: при выявления причин гибели молоди осетров, можно подобрать меры, снижающие отход и повышающие выживаемость мальков.
Изучить научно-методическую литературу по теме исследования.
Провести ихтиопатологическое обследование отхода молоди осетров.
Разработать рекомендации по снижению отхода молоди осетров.
Объект исследования: молодь осетров
Предмет исследования: выявление эктопаразитов молоди осетров при бассейновом выращивании
Практическая значимость. В ходе исследования были выявлены эктопаразиты молоди рыб в особых экологических условиях, что позволило провести оперативное лечение и устранение причин гибели, что повысило выживаемость молоди осетров.
ГЛАВА 1. ЭКОЛОГО-БИОЛОГИЧЕСКИЕ ОСНОВЫ ИХТИОПАТОЛОГИЧЕСКИХ МЕРОПРИЯТИЙ В РЫБНОМ ХОЗЯЙСТВЕ
Наша Рыбненская средняя школа находится в поселке Рыбное Дмитровского района Московской области, где с 1962 года работает Всероссийский научно-исследовательский институт пресноводного рыбного хозяйства (ВНИИПРХ), от которого отделилось дочернее предприятие малого бизнеса ООО «Селекцентр», которое занимается выращиванием, транспортировкой и торговлей рыбы, а также сопутствующими видами деятельности в области аквакультуры. Новым направлением деятельности ООО «Селекцентр» на сегодняшний день является подращивание молоди осетровых рыб для дальнейшей продажи в осетроводческие хозяйства, занимающихся выращиванием товарной продукции.
1.2 Причины заболевания рыб
При выращивании в аквакультуре у молоди осетровых неизбежно возникают заболевания как инфекционные, такие как бактериальные, вирусные, грибковые, так и инвазионные (например, заражение глистами), и еще встречаются незаразные болезни (Казарникова А.В., 2005; рис. 1).
Р ис. 1. Виды заболевания молоди осетров
За выращиваемой рыбой в рыбоводческих хозяйствах осуществляется должный ихтиопатологический контроль. Проводится визуальный контроль состояния рыб. По внешним признакам уже становится сразу заметно, какая рыба здорова, а какая снизила активность, плохо берет корм, имеет сложную траекторию движения и т.п., что явно определяет нарушения ее здоровья. Плохие условия содержания, не соответствующие технологическим нормативам приводят к заболеваниям как отдельных особей, так и массовым инфекциям.
Причинами, вызывающими заболевания рыб считаются:
Нарушение температурного режима,
Изменения содержания кислорода в воде,
Повышенная плотность посадки рыб,
Нарушения гидрохимического состава среды,
Наличие возбудителей заболеваний в среде,
Некачественные корма или отсутствие их и др.
Все эти факторы понижают иммунитет рыб и могут привести к болезням.
1.2 Возбудители болезней осетровых
2.1.1 Сапролегниоз. Дерматомикоз, которым является заболевание, вызванное низшими грибами сапролегнии, поражает у осетровых в основном кожный покров, жабры, плавники, места травмирования, потертостей, язв и т.п. Подвержены сапролегниозу рыбы с ослабленным иммунитетом, при этом усиливается основное заболевание, что часто приводит к гибели рыб. Однако, рыбы, хорошо питающиеся, могут сохранять невосприимчивость к сапролегнии, даже находясь в органически загрязненной воде.
Лечить сапролегниоз можно, применив ванны из сульфата меди или солевые, воздействуя формалином или малахитовым зеленым на пораженные организмы. Повышение аэрации воды способствует эффективной борьбе с возбудителем. Важным профилактическим действием против грибковых заболеваний является соблюдение санитарно-гигиенического режима.
2.1.2 Триходиниоз. Эту болезнь вызывают круглоресничные инфузории, трудно приживающиеся на здоровой рыбе. Ослабленная же рыба подвергается атаке и поражается возбудителем, быстро размножающимся и поражающим кожу и жабры, вызывая ослизнение. Триходины успешно размножаются в среде с недостаточным содержанием кислорода, большой органической загрязненностью, уплотненными посадками рыб и др. Для лечения рекомендуется малахитовый зеленый или препараты против эктопаразитов на его основе: Нилпа протоцид, Нилпа Акваформ, пунктола, контраИка и др.
2.1.3 Аргулёз. Нередко в прудах и бассейнах встречается заболевание аргулёз или вошь карпа. Небольшие паразиты присасываются к различным участкам тела рыб и высасывают кровь, паразитируя на них. Передача возбудителя может произойти при внесении живого корма – дафний и циклопов, пораженных аргулюсом.
2.1.4 Бактериальная геморрагическая септицимия (БГС). Это заболевания достаточно распространено в рыбоводных осетровых хозяйствах, возбудителями являются грамотрицательные аэромонады, энтеробактерии, флавобактерии, псевдомонады (Грищенко, 1999). Эти группы возбудителей очень активны в абиотической среде неблагоприятной для осетров, поэтому вызывают септические инфекции. Действие их на организм усиливается при совместном воздействии. Болезнь протекает как правило остро и длится долго. Лечить необходимо препаратами Антибак и пробиотиками. Основой профилактики БГС является четкое соблюдение санитарно-ветеринарных требований и проведение рыбоводно-мелиоративных мероприятий.
1.3 Методы лечения болезней осетровых рыб
Согласно комплексной методике, разработанной Головиной Ниной Александровной, д.б.н., для определения причин и лечения болезней применяют лекарственные средства, которые можно растворять в воде, где находятся осетры (в бассейне), добавлять в корм, а крупным рыбам можно делать инъекции при необходимости (табл. 2).
Таблица 1. Лекарства, применяемые для лечения болезней осетров
Ципрофлоксацин. Антибиотик (с кормом)
Энрофлоксацин, метронидизол (с кормом)
Флюмеквин, из группы фторхинолов (с кормом)
Фенасал. Антигельминтик (с кормом)
Фенасал. Антигельминтик (с кормом)
Дифлубензурон. Против аргулюсов и лерней
у карповых рыб (с кормом)
Нилверм. Против филометр (с кормом)
Пробиотик (с кормом) на основе Bacillies sublis
Пробиотик (с кормом)
на основе Bifidobacterium bifidum
Формалин, малахитовый зеленый (в воду)
Тетра Медика Дженерал Тоник*
Метиленовый синий, этакридинлактат, акрифлавий
Против плавниковый гнили, эктопаразитарных заболеваний
Тетра Медика КонтраИк*
Малахитовый зеленый, формалин, карбинола гидрохлорид
Против эктопаразинарных заболеваний
Тетра Медика ФунгиСтоп*
Серебро коллоидное, колидон, метаниловый желтый
Против грибковых и бактериальных инфекций
Для рыб применяют и иммунопрофилактику, так как повышение сопротивления организмов рыб к вирусным возбудителям очень важно в современном рыбоводстве.
Ихтиопатологу легче не допустить болезни, чем их лечить. Поэтому на первый план выходит профилактические мероприятия. Необходимо комплексно решать вопрос об организации профилактики, учитывая воздействие всех групп экологических факторов: абиотических, биотических и антропогенных. Мониторинг водной среды, обеспечение хорошими кормами будет способствовать поддержанию стабильности организма рыб. Здоровая, сильная и активная рыба реже подвергается инвазионным болезням. При завозе рыб из других местностей или возникновении болезней следует проводить карантинные мероприятия.
2. ОПРЕДЕЛЕНИЕ ЭКТОПАРАЗИТОВ МОЛОДИ ОСЕТРОВ ПРИ БАССЕЙНОВОМ ВЫРАЩИВАНИИ
Исследования мы проводили в рыбоводческом модуле, приспособленном для подращивания молоди осетровых. Гидрохимический режим соответствовал нормативным показателям.
Ежедневно в 10 утра в течение июля месяца 2018 года я совместно с рабочим по модулю собирала из 6 бассейнов отход молоди, то есть погибших рыб (табл. 1, рис. 1). Мне нужно было определить причину гибели молоди. Для исследования были выбраны бассейны указанные руководством хозяйства.
Исследуемым объектом был отход и больные особи с нарушениями поведения и движения. Контролем для исследуемых мальков были здоровые рыбы.
Рис. 1. Отход осетров в бассейнах
В соответствии с методикой Правдина И.Ф. по клиническому исследованию рыб я проводила первоначально визуальный осмотр умерших, больных и здоровых рыб. Брала соскобы с поверхности тела, хвоста и жабр и готовила микропрепараты, которые рассматривала под микроскопом, занося данные в специальные листы осмотра ежедневно по каждому бассейну. В сводной таблице представлены результаты исследований на выявление эктопаразитов (табл.2).
Таблица 2. Результаты опыта
Количество рыб, в шт.
рыб в бассейне на начало опыта
рыб в бассейне на конец опыта
погибших рыб за опыт
Осмотренных здоровых рыб
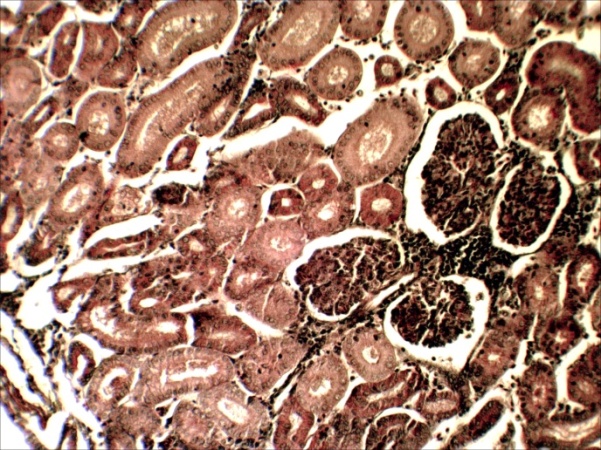
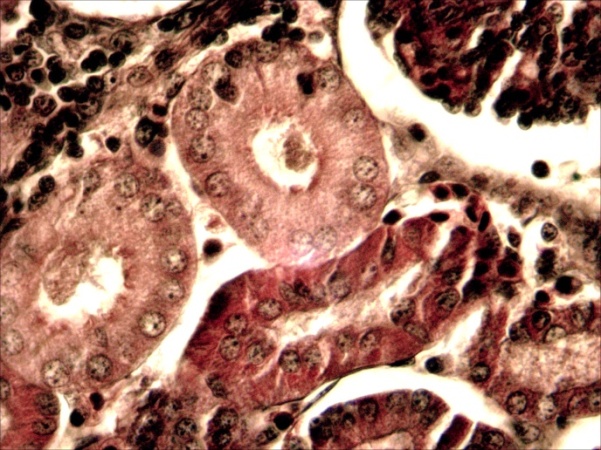
В условиях ООО «Селекцентр» при бассейновом выращивании молоди осетров в июле 2018 года были обнаружены возбудители: грибковые (сапролегния) практически на всех осмотренных мальках (699/75,8% из 922), паразитарные (триходины) – на трех больных мальках, другие инвазии не проявлялись, хотя было обнаружено 12 организмов с невыясненной нами этиологией на больных и погибших мальках.
Сапролегниоз вызвал у погибшей молоди повреждения кожных покровов, кровоподтеки, повреждения плавников, обволакивание жабр разросшимся мицелием. Несомненно, причина гибели большинства умерших мальков было заражение сапролегнией. Бассейны под №№4, 5, 6 имели ослабленный водоток, так как размещались последними в модуле, вероятно это привело к скоплению и быстрому развитию сапролегниоза. Нами были проведены однократная обработка фиолетовым К и солевые ванны, что дало положительный эффект и позволило повысить выживаемость рыб.
Обнаруженные на соскобах с кожных покровов трех мальков триходины, не послужили причиной массового заболевания мальков, но в силу небольшого процента поражения ими, принятые меры профилактики не дали возможности развиваться паразитам.
Бактериальная геморрагическая болезнь осетровых не была выявлена ни визуально, ни при исследовании под микроскопом.
Других паразитических форм нами выявлено не было ни при визуальном осмотре, ни при исследовании соскобов с поверхности тела под микроскопом.
В связи с особенностями температурного режима как воды, так и воздуха после применения остатков просроченного (недоброкачественного) корма однократно было выявлено заболевание пищеварительной системы, проявившееся вздутием брюшка у рыб одного бассейна (№6).
В процессе наблюдения нами выявлены случаи появления ослабленных и погибших рыб после проведения ручных манипуляций в бассейнах (хендлинг), например ручная чистка бассейна. Рыба может быть прижата, ушиблена или повреждена друг о друга. Данную процедуру следует проводить аккуратнее или применять анестезирующие вещества при возможности.
Временная остановка подачи воды в бассейны (один случай 22 июля за опытный период) также может привести к отходу. Большая часть рыб восстанавливает свою активность, но некоторы не могут перенести недостаток растворенного кислорода.
Таким образом, в процессе исследования нами были осмотрены на предмет выявления экзопаразитов 922 малька сибирского осетра. Выявленные паразитические виды (сапролегния, триходины) вероятно заносятся с водой через прудовую воду, которая подается для усиления водообмена в летний период. Малое разнообразие паразитических форм, выявленных в ходе опыта, говорит о благополучном состоянии водной среды в модуле по выращиванию осетров. Профилактические мероприятия, проводимые в рыбхозе отвечают санитарно-ветеринарным требованиям и обеспечивают борьбу с возможными заболеваниями.
Причиной гибели молоди стала развившаяся в период высоких летних температур воды сапролегния, гифы которой поразили кожные покровы, жабры и тело погибших рыб и споры, гифы также были обнаружены на здоровых рыбах.
Наличие паразитов триходин не явилось причиной распространения заболевания, так как нами своевременно были проведены профилактические мероприятия (солевые ванны и обработка фиолетовым К). При повторных осмотрах они больше не выявлены.
Причиной заболевания рыб могут быть не только инвазии, но и стресс-факторы, недоброкачественные корма, изменения гидрохимического режима среды, последствия хендлинга и др.
Разработаны рекомендации для хозяйства по повышению выживаемости молоди.
РЕКОМЕНДАЦИИ ПО СОВЕРШЕНСТВОВАНИЮ БАССЕЙНОВОГО ВЫРАЩИВАНИЯ МОЛОДИ ОСЕТРОВ В МОДУЛЕ
Обеспечить подачу в бассейны для выращивания осетров качественную воду, соответствующую нормативам и санитарно-ветеринарным требованиям.
Максимально снизить стресс-факторы. Влияющие на рыб, при осуществлении хэндлинга.
Установить дополнительные механические фильтры для очистки подаваемой в модуль воды.
Предусмотреть в перспективе замкнуты водопровод с очисткой для усиления водоподачи в чрезвычайных ситуациях и в летний период.
Осуществлять постоянный ихтипатологический контроль за состоянием рыбы в процессе выращивания.
Соблюдать требования по плотности посадки рыб в бассейны.
Проводить систематическую профилактическую противопаразитарную обработку рыб в бассейнах.
Соблюдать карантинные мероприятия при завозе рыб в хозяйство, пересаживании в бассейнах и при возникновении заболеваний.
Применять для кормления рыб корма, соответствующие возрастной группе, сбалансированные, непросроченные, доброкачественные.
Использовать для профилактических целей витаминные добавки при кормлении рыб, повышающие иммунитет.
Применять для лечения и профилактических мероприятий современные лекарственные средства нового поколения.
Ввести должность ихтиопатолога в штат.
Оборудовать экспресс-лабораторию по проведению гидрохимического анализа воды, исследованию рыб (приобрести новый более мощный микроскоп), аппарат УЗИ для рыб.
Выписать периодические издания, научно-методические журналы о новых методах выращивания, профилактики и лечения рыб.
ТРЕБОВАНИЯ К ВОДЕ ПРИ ВЫРАЩИВАНИИ ОСЕТРОВ
Таблица 1. Предельно допустимые концентрации некоторых вредных веществ в воде рыбохозяйственных водоемов (Привезенцев, Власов, 2004)
Болезни осетровых рыб таблица
За рубежом у осетровых рыб выявлено 10 различных вирусов. Четыре из них — аденовирус (WSAV), иридовирус — (WSIV) и два герпесвируса (WSHV-1 и WSHV-2) у белого осетра (в США) и один иридовирус (RSIV) — у русского осетра (в Бельгии) вызывают тяжело протекающие заболевания у молоди.
Возбудители
Вирусы, выделенные от белого осетра в США, являются ДНК-геномными. Наиболее опасными и широко распространенными агентами из четырех считаются иридовирус (WSIV) и герпесвирус-2 (WSHV-2). Герпесвирусы легко выделяются на культурах клеточных линий WSS-2, WSSK-1, WSGO. Иридовирус выделяется на культуре клеток с трудом, аденовирус выделить на клеточных культурах не удается. Иридовирус (RSIV) от русского осетра обнаружен при электронной микроскопии в виде скопления частиц диаметром 283 нм. Они несколько крупнее, чем вирионы WSIV.
Эпизоотология
Заболевания развиваются весной, в начале лета и осенью при температуре воды 9—20 °С и осложняются миксо-бактериозом и протозойными инвазиями. Стресс является фактором, провоцирующим вспышки эпизоотии, которые сопровождаются гибелью 80—95 % выращиваемой молоди белого осетра в США. Рыбы старшего возраста не болеют, но являются вирусоносителями. Дикие производители считаются главным источником возбудителей инфекций. Вирусы передаются через воду и возможен вертикальный путь передачи вирусов от производителей потомству. Заболевание молоди русского осетра, вызванное иридовирусом RSIV, вспыхнуло в одном из хозяйств Бельгии после завоза молоди и икры. Гибель четырехмесячной молоди достигала 50 %.
Клинические признаки и патогенез
У больных рыб отмечают анорексию, истощение, угнетение, бледность жабр. Для иридо-вирусного поражения характерно увеличение брюшка и покраснение жучек. Вирус поражает эпидермис жабр и ротоглотки. Герпесвирус локализуется в эпидермисе различных участков тела, в мышечной стенке, в жабрах. У заболевших рыб наблюдают гиперемию и изъязвления на вентральной части рострума, в области рта и ануса, очаговые скопления слизи на голове и грудных плавниках. При поражении аденовирусом у молоди отмечают истощение, бледность печени, отсутствие корма в кишечнике. Молодь русского осетра, пораженная RSFV, не реагирует на раздражители, отказывается от корма, приобретает бледную окраску тела, плавает в вертикальном положении, теряет равновесие и погибает. В жабрах больных рыб обнаруживают мелкие кровоизлияния.
Диагноз
Его ставят на основании клинических и эпизоотических данных и подкрепляют результатами вирусологических исследований. Гистологические исследования позволяют выявить наличие большого числа гипертрофированных базофильных клеток в эпидермисе ротоглотки.
Меры борьбы
Они сводятся к созданию оптимальных условий выращивания для рыбы первого года жизни. При отсутствии стрессовых воздействий даже инфицированная молодь белого осетра, но без клинических признаков заболевания выпускается в природные водоемы Северо-Запада США.
Разработка методических указаний по ранней диагностике и профилактике инфекционных болезней, в т.ч. герпесвирусной болезни осетровых рыб (молоди)
Титульный лист и исполнители
РЕФЕРАТ
Отчет 34 с., 22 рис., 8 табл., 14 источников.
ГЕРПЕСВИРУСНАЯ БОЛЕЗНЬ, ЗАРАЖЕНИЕ, МЕТОДЫ ВИРУСОЛОГИЧЕСКИЕ, ПАТОМОРФОЛОГИЧЕСКИЕ, ДЕСКВАМАЦИЯ ЭПИДЕРМИСА, НЕКРОЗЫ В ПЕЧЕНИ И ПОЧКАХ, ГЛОМЕРУЛОНЕФРИТ, ЭНТЕРИТ
Объектами для экспериментального заражения и лабораторных исследований являлись мальки и сеголетки сибирского и русского осетров.
Цель работы – на основании вирусологических и патоморфологических исследований усовершенствовать методы ранней диагностики герпесвирусной болезни молоди осетровых рыб и разработать методические указания по диагностике и профилактике инфекционных болезней (герпесвирусной болезни) молоди осетровых рыб.
В процессе работы проводили экспериментальное заражение мальков русского и сибирского осетров герпесвирусом SbSHV (изолят SK/1114) и в динамике развития болезни комплексно исследовали рыб с применением вирусологических, клинических и патоморфологических методов.
В результате исследований впервые экспериментально установлена чувствительность к заражению герпесвирусом молоди (мальков) русского и сибирского осетров на ранней стадии развития, что позволяет рекомендовать использовать мальков в качестве тест-объектов для постановки биопроб при диагностике болезни. Получены новые данные об особенностях течения и клинического проявления и патоморфологические изменения при герпесвирусной болезни, которые используются как основа для постановки предварительного диагноза.
При определении патогенности миксобактерий и аэромонад (Aeromonas verоnii) осложняющих течение герпесвирусной болезни, установлено, что заражение интактных сеголеток происходит только аэромонадами и только при внутримышечном способе заражения.
Экспериментально доказана возможность использования витамина С для профилактики герпесвирусной болезни у мальков сибирского осетра.
Разработаны и рекомендованы для внедрения в практику Методические указания «Диагностика и профилактика герпесвирусной болезни и вторичных инфекций молоди осетровых рыб», что обеспечит повышение эффективности индустриального осетроводства за счет своевременной диагностики болезни и проведения профилактических мероприятий.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
В настоящем отчете о НИР применяются следующие термины и определения:
Аквакультура – выращивание водных организмов в искусственных водоемах
Аэромонады – бактерии рода аэромонас
Бестер – гибрид белуги и стерляди
Гиперплазия – размножение клеток в тканях
Гломерулонефрит – воспаление в клубочках почек
Дистрофия гидропическая – белковая дистрофия, проявляющаяся появлением в цитоплазме клеток вакуолей, заполненных жидкостью
Заражение методом ванн – выдерживание рыб в воде, зараженной вирусом, бактериями
Жучки – это ряды костяных щитков (головные, брюшные, спинные), характерные для рыб осетровых пород
Инкубационный период – время от момента заражения вирусом до появления симптомов болезни
Кариопикноз – сморщивание ядер клеток
Кумулятивная гибель – суммарная гибель рыб в течение эксперимента
Мальки – молодь рыб возрастом до 1 месяца
Миксобактериоз – болезнь, вызываемая слизистыми бактериями (миксобактериями)
Некронефроз – омертвение (некроз) почечных канальцев
Осетры – рыбы семейства Осетровых
Осетры русский, сибирский (син. ленский) – виды осетровых рыб
Сеголетки – молодь рыб возрастом до 1 года
Сапролегниоз – болезнь, вызываемая грибком сапролегния
SbSHV –герпесвирус сибирского осетра
SSO-2 – обозначение культуры клеток, полученной из тканей печени, почек, селезенки сибирского осетра Acipenser baeri
WSS-2 – обозначение культуры клеток, полученной из тканей селезенки белого осетра Acipenser transmontanus
ВВЕДЕНИЕ
В настоящее время осетровых рыб выращивают в аквакультуре по интенсивной технологии – в основном с целью получения пищевой икры и мяса, меньше – для пополнения естественных запасов осетровых. Сейчас в РФ работает более 80 осетровых хозяйств разного профиля. В 2019 г. мировое производство осетровых на мясо составило 93,5 тыс. т, в т.ч. в Китае 83,0 т, РФ 2,5 тыс. т, производство икры – около 200 т, в т.ч. в Китае – 50 т, РФ всего – 20 т.
Болезни осетровых рыб наиболее распространены в аквакультуре и наносят значительный экономический ущерб, составляющий примерно 10% от общих затрат на их выращивание Инфекционные болезни, особенно вирусные, изучены значительно хуже, чем инвазионные, по ним практически отсутствуют нормативные документы. Поэтому, изучение герпесвирусной болезни, появившейся в последние годы, и осложняющих ее бактериозов является актуальным [3,4].
Впервые болезнь выявлена у белого и тупорылого осетра в конце ХХ века в США и Канаде [14]. В России первая вспышка болезни, сопровождавшаяся массовой гибелью молоди сибирского осетра, отмечена весной 2006 г. Однако, эпизоотическая ситуация по данной болезни в РФ окончательно не выяснена, но герпесвирус выделен еще в 2-х хозяйствах РФ и в одном рыбхозе Казахстана. Предполагают, что он был занесен в них с посадочным материалом сибирского осетра, полученным из вышеуказанного неблагополучного хозяйства [12, 13].
Возбудитель болезни – герпесвирус SbSHV группы Acipenserid herpesvirus 2 (AciHV2). В России он выделен от сибирского осетра, генетически близок к канадскому изоляту, изучена его структура и биологические свойства, в т.ч.вирулентные [12,13]. Он относится к семейству Alloherpesviridae, роду Ictalurivirus, обладает тропизмом к эпителиальным тканям, особенно к кожному эпидермису, репродуцируется исключительно в перевиваемых культурах клеток сибирского осетра SSO-2 и белого осетра WSS-2 при температуре 15-17ºС. Основными источниками возбудителя являются больные рыбы и их трупы, а путями передачи инфекции – вода, орудия лова и другие предметы ухода. Не исключена передача вируса от производителей их потомству, хотя этот вопрос пока не изучен.
Нами в 2012-2018 гг. в серии опытов по экспериментальному воспроизведению герпесвирусной болезни и при ее спонтанном течении подробно изучены симптомы и патоморфологические изменения у сеголеток сибирского осетра и его гибрида с русским осетром возрастом 2-6мес. Полученные результаты опубликованы в 7 научных статьях (в т.ч. 3 в изданиях ВАК) и в одной лекции (2018 г.), и вошли в кандидатскую диссертацию (2018 г.) [5,6,7,8,9,10]. В то же время недостаток данных о чувствительности к вирусу основного объекта осетроводства – русского осетра, а также проявлении болезни у ранней молоди (мальков) осетровых сдерживает разработку обоснованных методов диагностики и профилактики болезни.
Цель работы – на основании вирусологических и патоморфологических исследований усовершенствовать метод диагностики инфекционных болезней (герпесвирусной болезни) молоди осетровых рыб на раннем этапе развития и разработать методические указания по диагностике и профилактике заболеваний.
воспроизвести экспериментально герпесвирусную болезнь молоди осетровых рыб;
провести исследования и определить наиболее характерные патоморфологические изменения внутренних органов молоди осетровых рыб с применением гистохимических методов исследования;
разработать методические указания по ранней диагностике и профилактике инфекционных болезней (герпесвирусной болезни) молоди осетровых рыб.
1 Материал и методы исследований
Объектами исследований служили мальки русского (Acipenser gueldenstaedti) и сибирского (Acipenser baeri) осетра массой 5-8 г. возрастом до 1 мес., полученные из производственных рыбопитомников и доставленные автотранспортом. После транспортировки рыб пересаживали в проточные аквариумы емкостью 70 л с артезианской водой, адаптировали к условиям аквариумов в течение 15 дней путем постепенного понижения температуры воды до 15-17°С и достижения устойчивого потребления рыбами комбикорма марки ЛимКорм помола № 1,5 мм. Опыты ставили в 2-3-х кратной повторности в тех же аквариумах на артезианской воде, отвечающей рыбоводным требованиям, при температуре 15 – 17 о С. Формировали опытные и контрольные группы рыб в количестве не менее 10 экз. и рассаживали их в соответствующие аквариумы. Поставлено 2 опыта по экспериментальному заражению герпесвирусом мальков русского (опыт №1) и сибирского (опыт 2) осетра, опыт 3 по определению профилактической эффективности витамина С и опыт 4 по дополнительному заражению сеголеток миксобактериями и аэромонадами (более подробные схемы опытов см. в разделе Результаты исследований). Общим контролем для всех опытов являлись незараженные мальки (сеголетки) русского и сибирского осетров.
Во всех опытах проводили клинические наблюдения и учет гибели рыб, патологоанатомическое вскрытие, гистологические и вирусологические, а также выборочно гематологические и бактериологические исследования рыб общепринятыми методами (Таблица 1). В целом, длительность наблюдений в опытах составила 85 суток.
Для экспериментального заражения рыб использовали герпесвирус SbSHV (изолят SK/1114). Мальков опытных групп заражали методом ванн путем выдерживания рыб в водной суспензии вируссодержащей культуры клеток в течение 1 часа с конечной концентрацией вируса в воде 10 4 ТЦД50/мл. По ходу опытов периодически осуществляли вирусологические исследования патматериала от здоровых и заболевших рыб. В качестве патматериала в основном использовали отрезанные стерильно кусочки грудных или брюшных плавников. Отбор проб проводили перед заражением вирусом, в период проведения опытов — от свеже погибших и вынужденно убитых рыб с явно выраженными признаками болезни и в конце опытов от оставшихся живых мальков. Погибших рыб исследовали индивидуально, а от вынужденно убитых готовили смешанные пробы минимум от 3-х экз. Для выделения герпесвируса применяли культуры клеток SSO-2 иWSS-2, идентификацию вируса проводили в реакции нейтрализации. Зараженные клеточные линии инкубировали в охлаждающем термостате при температуре 15°С с повышенным содержанием углекислого газа. На вышеуказанных линиях клеток было проведено от одного до трех пассажей каждого материала продолжительностью 9-15 суток. Титр вируса определяли в каждом материале с развитым цитопатическим эффектом и рассчитывали по методу Рида и Менча. Всего исследовано вирусологически 127 экз. сибирского осетра и 76 экз. русского осетра.
Патологоанатомическому вскрытию подвергали контрольных, заболевших и погибших мальков, для гистологических исследований вынужденно убитых и свежепогибших рыб фиксировали целиком в забуференном 10%-ном растворе формалина.
Гематологические исследования проводили в динамике при экспериментальной вирусной инфекции сибирского и русского осетров (опыты1,2) и в опыте 3 по испытанию профилактической эффективности витамина С. Исследования во всех опытах были проведены через 4 дня после заражения рыб (в инкубационный период), а в опыте 1 с русским осетром повторно через 11 дней после заражения (в период клинического проявления болезни).
В каждом случае пробы крови отбирали у 6 экз., всего исследованиям подвергнуты 48 рыб. Кровь исследовали общепринятыми методами [1,2] по следующим показателям:
уровень гемоглобина – цианметгемоглобиновым фотометрическим методом на фотоколориметре КФК-2МП;
число эритроцитов – пробирочным методом с подсчетом в камере Горяева;
расчет содержания гемоглобина в эритроците по формуле Гительсона и Терского;
процентное соотношение незрелых форм эритроцитов на мазках крови;
абсолютное количество лимфоцитов, нейтрофилов и моноцитов.
Опыт 3 по определению профилактической эффективности витамина С поставили в 2-вариантах:
1-й вариант –кормление рыб без применения витамина С:
контроль 1- рыбы не зараженные герпесвирусом (30 экз.)
опыт 1 –рыбы, зараженные герпесвирусом (37 экз.)
2-й вариант – кормление рыб с добавкой витамина С:
контроль 2 – рыбы, не зараженные герпесвирусом (30 экз.);
опыт 2 – рыбы, зараженные герпесвирусом(30экз.).
В обоих вариантах опыта рыб кормили осетровым комбикормом марки ЛимКорм (помол № 1,5 мм) 2 раза в сутки, дозировали по поедаемости корма рыбами. Во 2-м варианте опыта в корм добавляли витамин С из расчета 1 г витамина на 1 кг комбикорма. В опыте 2 (вариант 2) рыб кормили витаминным кормом в течение 7 дней до заражения вирусом и 3-х дней после заражения, затем скармливали обычный корм. Рыбам в контроле 2 аналогичный корм задавали по той же схеме, но герпесвирусом не заражали. Клинические наблюдения, вирусологические, патоморфоогические и гематологические исследования проводили по той же схеме, что и в опытах 1,2.
Опыт 4 по заражению рыб миксобактериями и аэромонадами проведен на тех жемальках сибирского осетра, подрощенных домассы 15-20 г, в 2-х вариантах. В первом варианте эксперимента провели заражение рыб (20экз.): в одной группе миксобактериями и во второй бактериями Aeromonas veronia методом ванн.
В первом варианте эксперимента провели заражение рыб (20экз.) миксобактериями. В воде опытного аквариума создали концентрацию клеток миксобактерий 10000 КОЕ/мл. Затем в аквариум для заражения посадили 20 мальков осетра, которых выдерживали 2 часа при аэрации воды. После заражения рыб была включена проточность воды и продолжалось ежедневное наблюдение в течение 15 дней. Второй опыт провели таким же методом, но рыб (20экз.) заражали смесью вирулентных аэромонад с зонами деполимеризации ДНК 11,0; 8,0 и 9,0 мм.
Во втором варианте смесь вирулентных штаммов аэромонады вводили рыбам внутримышечно в дозе 0,1 мл. Посевы с паренхиматозных органов зараженных рыб с целью реизоляции использованных в опытах культур проводили на среды: эритритагар для определения уровня общей бактериальной контаминации; Эндо – выявления энтеробактерий, в т.ч. аэромонад, неферментирующих щелочеобразователей (моракселл, ацинетобактера); Сабуро – выявления грибковой флоры и миксобактерий; энтерококкагар – выявления стрептококков.
Статистическую обработку результатов проводили с использованием программы Excel с определением достоверностей между группами (при уровне достоверности 95%).
Таблица 1 – Объем исследований
| Виды рыб и методы исследований | Количество рыб/проб |
| Количество рыб в опытах: | 203 |
| – сибирский осётр | 150 |
| – русский осётр | 53 |
| Виды исследований: | |
| – клинические | 203 |
| – гематологические | 48 |
| – патологоанатомические | 128 |
| – гистологические | 60 |
| – вирусологические | 203 (проб) |
| – бактериологические | 20 (проб) |
2 Результаты исследований и их обсуждение
2.1 Опыт 1. Заражение герпесвирусом мальков русского осетра
Опыт поставлен на мальках русского осетра (33 экз.) возрастом около 1 месяца средней массой 8 г, доставленных автотранспортом из Краснодарского края (около 1200км).
Течение, симптомы и патологоанатомические изменения у подопытных мальков.
Обобщенные данные о сроках проявления инфекции, динамике развития клинических признаков и гибели рыб представлены в таблицах 2, 3. Из таблицы 2 видно, что инкубационный период длился 8 суток, стадия явного проявления болезни – 10 суток, и общая продолжительность инфекционного процесса составила 18 суток. Гибель рыб началась через 10 дней, постепенно нарастала и достигла 97 % (таблица 3).
Таблица 2 – Динамика развития клинических признаков болезни у мальков русского осетра
| Количество дней после заражения | Клинические признаки |
| 8 | Вялость, апатия, отказ от корма, энофтальм, бледные пятна на коже |
| 10-12 | Геморрагии, некротический распад кончиков плавников, увеличенное брюшко, воспаление прямой кишки |
| 11-18 | Нарушение координации движения, адинамия |
Таблица 3 – Кумулятивная гибель заболевших мальков, n = 33
| Количество дней с момента заражения | 8 | 10-12 | 13 | 14 | 14-18 |
| Кумулятивная гибель, экз/% | – | 12/36 | 14/42 | 22/67 | 31/97 |
Симптомы болезни вначале выражались замедлением движения, апатией, отказом рыб от корма, появлением бледных пятен на кожном покрове. В дальнейшем у части рыб, преимущественно в области хвостового стебля, возникали пятнистые геморрагии, очаги некротического распада кончиков плавников, воспаление и выпячивание прямой кишки, развивался энофтальм (Рисунок 1, 2).
Рисунок 1 – Геморрагии в области хвостового стебля (увеличено)
Рисунок 2 – Воспаление, выпячивание прямой кишки (увеличено)
В терминальной стадии болезни рыбы держались на дне, плавали на боку, периоды неподвижности чередовались с резкими хаотичными движениями. Отдельные особи опускались на дно аквариума и принимали позу «стояния» на грудных плавниках (рисунок 3).
 |  |
| А | Б |
Рисунок 3 – Положение вверх брюшком (А), «опора» на грудные плавники (Б), энофтальм.
У рыб контрольных рыб вышеописанные симптомы не проявлялись (рисунок 4).
Рисунок 4 – Малёк русского осетра из контрольной группы (увеличено)
2.1.1 Результаты вирусологических исследований
При вирусологическом исследовании от заболевших рыб выделен исходный вирус. Признаки ЦПД в культурах клеток SSO-2 и WSS-2 выявлялись в 1 пассаже после инокуляции всех проб патологического материала. ЦПД проявлялось округлением и отслоением клеток монослоя.
2.1.2 Результаты гематологического анализа
В инкубационный период у рыб зараженной группы по сравнению с контрольными рыбами выявлено снижение количества эритроцитов на 14,9%. Изменения уровня гемоглобина не отмечены
В лейкоцитарной картине крови рыб опытной группы выявлено снижение общего количества лейкоцитов относительно контрольной группы рыб на 18,7 (с 14,81 до 12,03 тыс./мкл). В лейкоцитарной формуле у подопытных рыб отмечено: незначительное снижение процента нейтрофилов на 14,9% при параллельном повышении процента молодых нейтрофилов (миелоцитов и др.) и лимфоцитов на 18,9%, значительное увеличение моноцитов и эозинофилов (в 2-3 раза), а также появление в крови плазматических клеток (0,67%). Такая же картина прослеживается при пересчете лейкоцитарных клеток в абсолютные значения.
В период явного проявления признаков заболевания у опытной группы рыб (через 11 дней после заражения) показатели красной крови имели аналогичную динамику: снижение количества эритроцитов на 10,0% при увеличении концентрации гемоглобина в эритроцитах на 5% (таблица 4).
Таблица 4 – Гематологические показатели русского осетра при заражении герпесвирусом
Наиболее значимые изменения выявлены в лейкоцитарном профиле крови. Общее количество лейкоцитов снизилось в среднем на 48,5% с разбросом колебаний снижения от22,6% до 3-х кратного (от 20,83 ±1,40 до 6,73 ±1,30 тыс./мкл). В лейкоцитарной формуле выявлено увеличение общего процента нейтрофилов на 75,6% (при сдвиге формулы влево) и моноцитов – в 7 раз, снижение лимфоцитов на 26,5% и повышение в крови плазматических клеток до 1,67 % (рисунок 5).
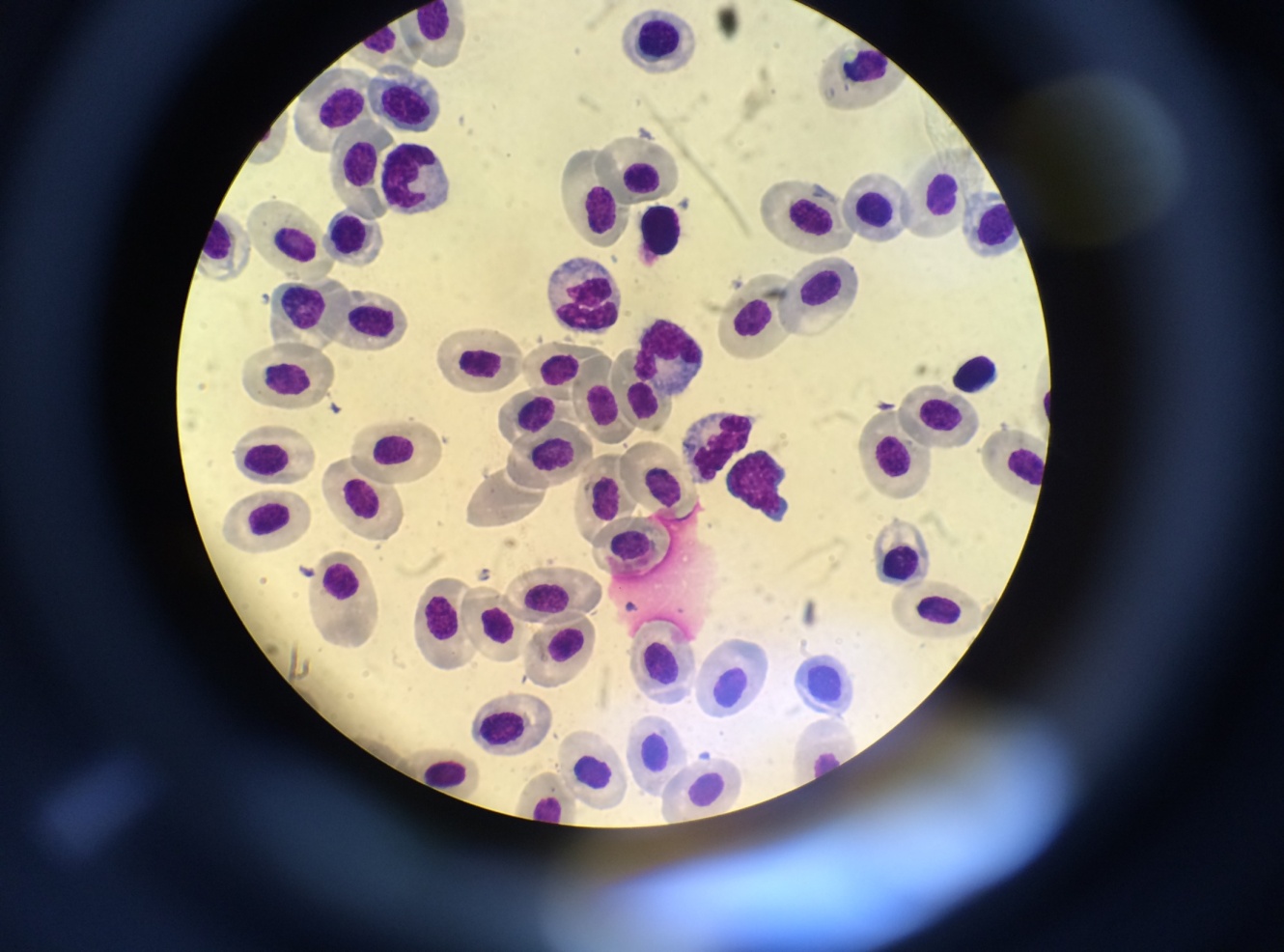
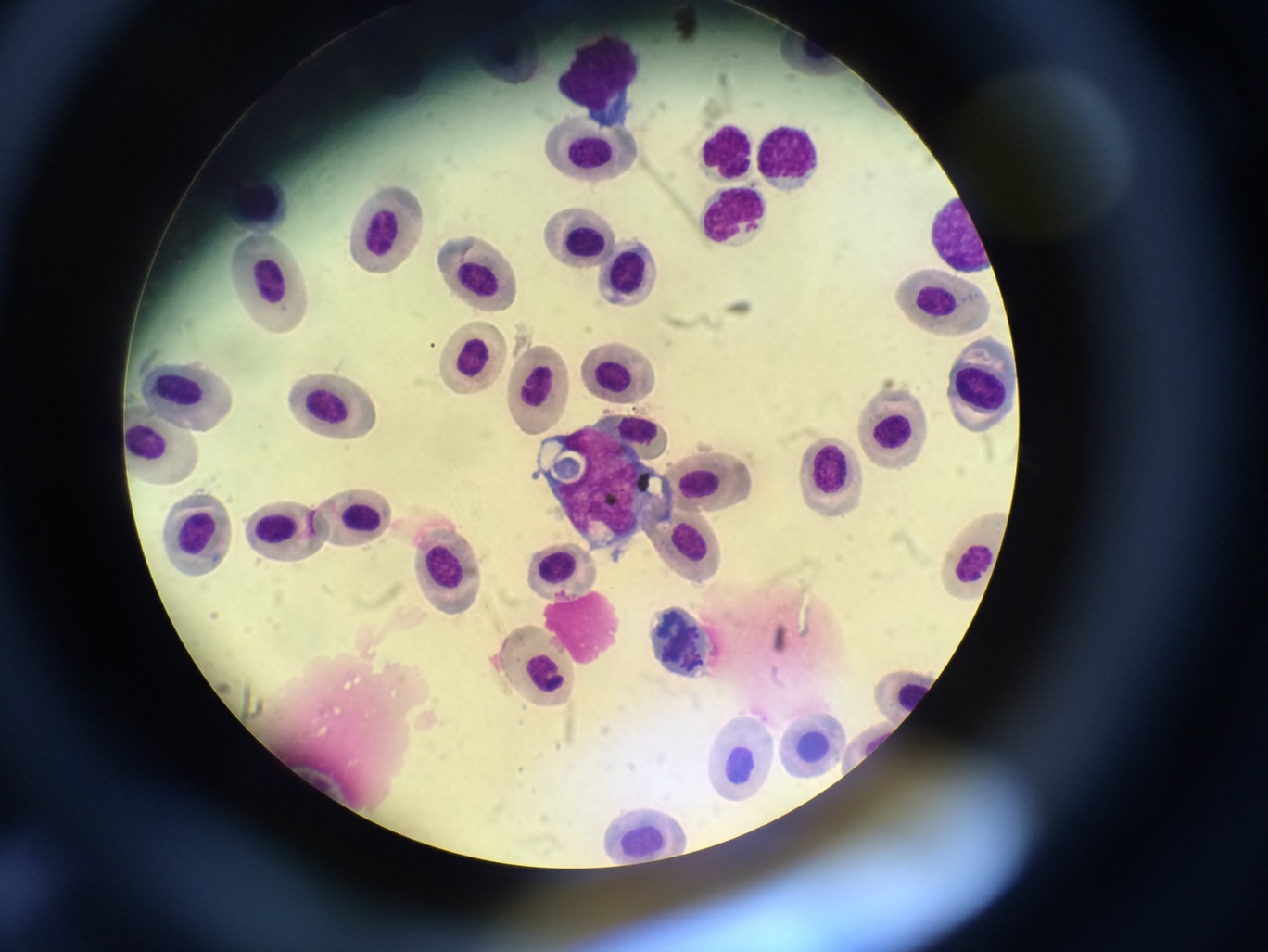
В мазках крови также обнаруживали моноциты и макрофаги с фагоцитированными частицами (рисунок 6). В нейтрофилах цитоплазма окрашивалась в голубовато-синеватый цвет с токсической зернистостью, что свидетельствует о дефекте нейтрофилов, связанном с патогенным действием вируса, снижающим их фагоцитарную активность. В целом, картина крови характерна для острого течения инфекционного процесса; появление плазматических клеток свидетельствует об активизации иммунологических реакций и синтеза антител.
 |  |
| А | Б |
Рисунок 5 – Нейтрофилы (А) и плазматическая клетка (Б) в крови у зараженных рыб
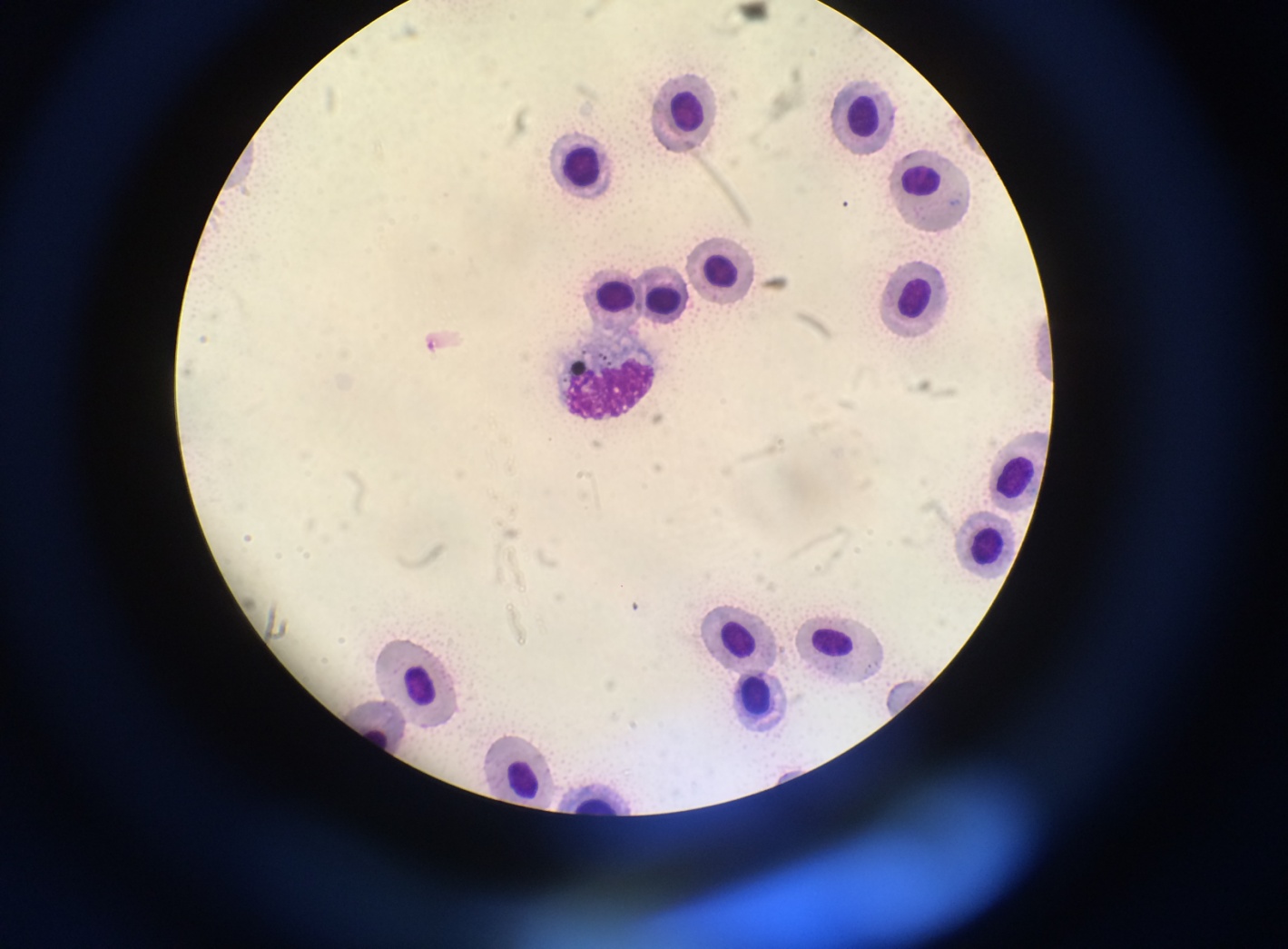 |  |
| А | Б |
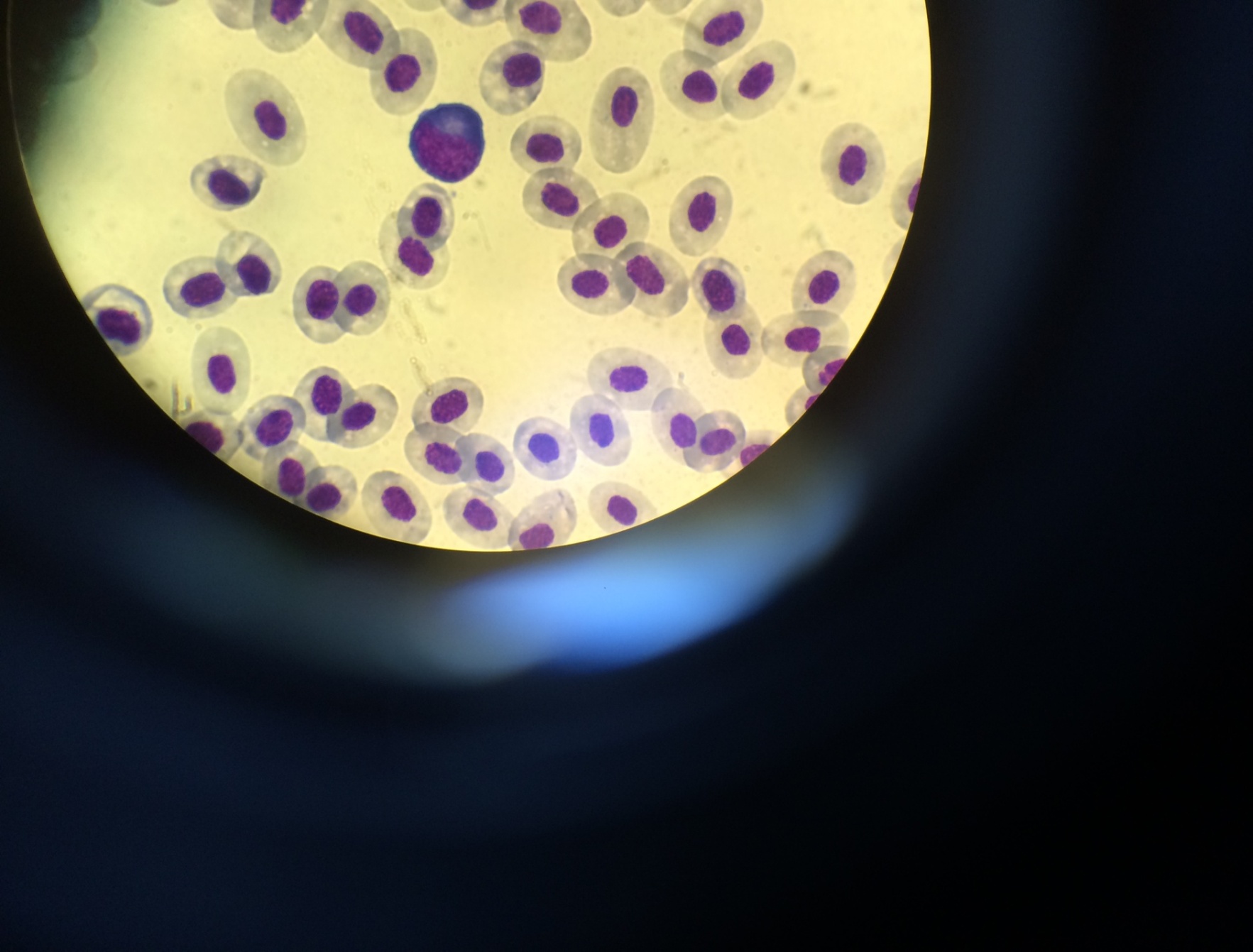
Рисунок 6 – Моноцит (А) и макрофаг (Б) с фагоцитированными частицами
2.1.3 Патоморфологические изменения
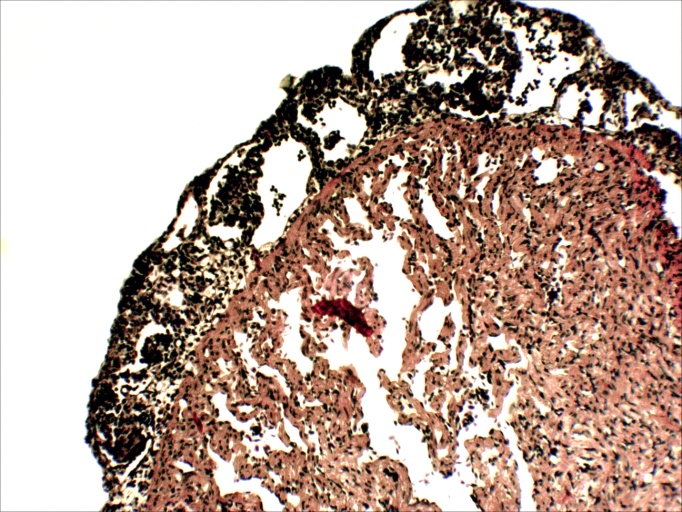
Патологоанатомические изменения выражались в следующем: на наружных покровах обнаруживались в основном точечные и пятнистые кровоизлияния в основании жучек, на коже хвостового стебля и брюшка, некротический распад кончиков плавников, покраснение и выпячивание кишечника. При вскрытии печень бледная серо-белого цвета, размягчена, селезенка с бледными пятнами на поверхности, кишечник без кормовых масс, заполнен густой слизью, слизистая оболочка пятнисто гиперемирована (рисунок 7).
Рисунок 7 – Русский осетр. Печень увеличена, бледная, пятнистая (увеличено)
2.1.4. Гистологические изменения
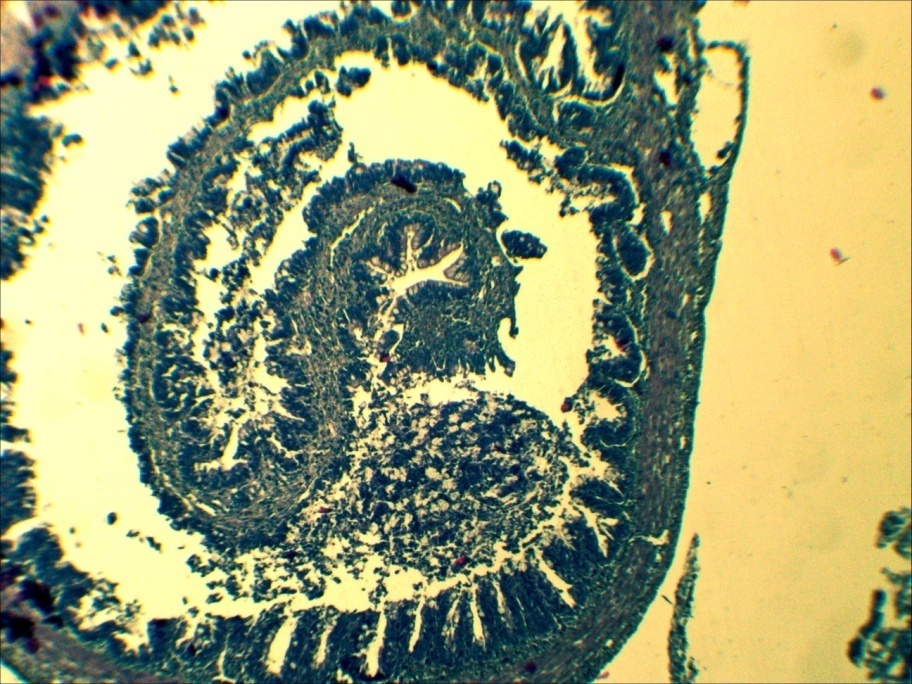
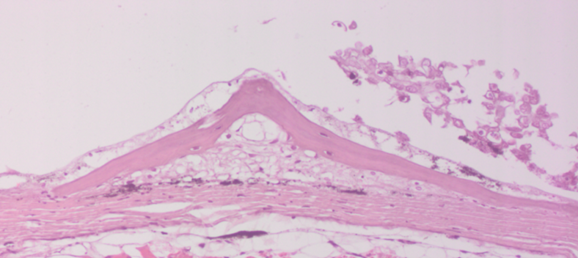
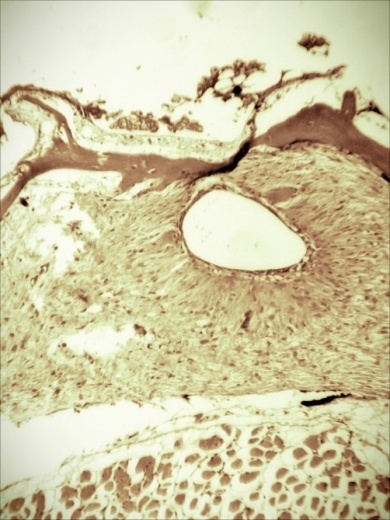
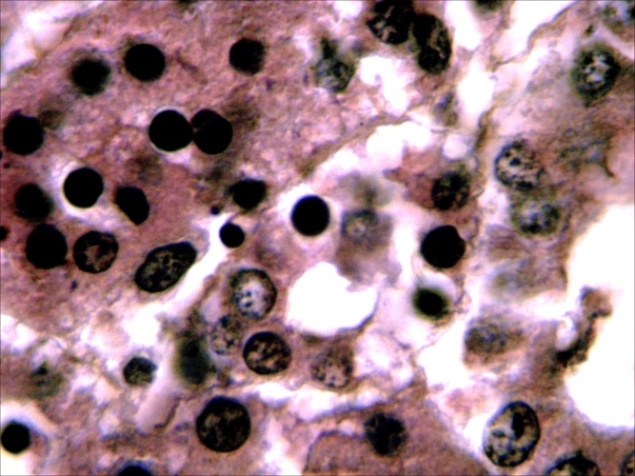
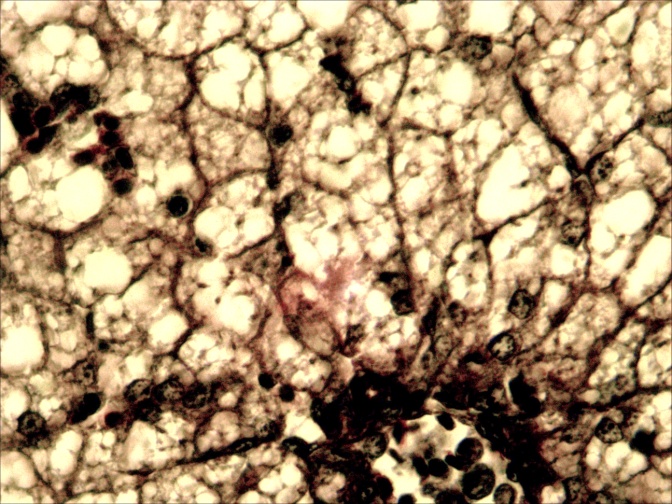
У больных мальков микроструктурные изменения кожи проявлялись в виде некроза и распада слизистых клеток, десквамации эпидермиса в области жучек (рисунок 8).
 |  |
| А | Б |
Рисунок 8 – Кожа. Некроз (А) и слущивание эпидермиса (Б). Ок.10, об. х20. Окраска гематоксилин-эозин (Г.Э.)
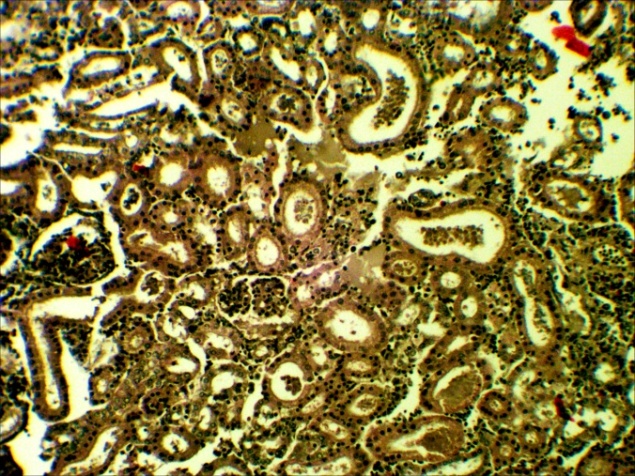
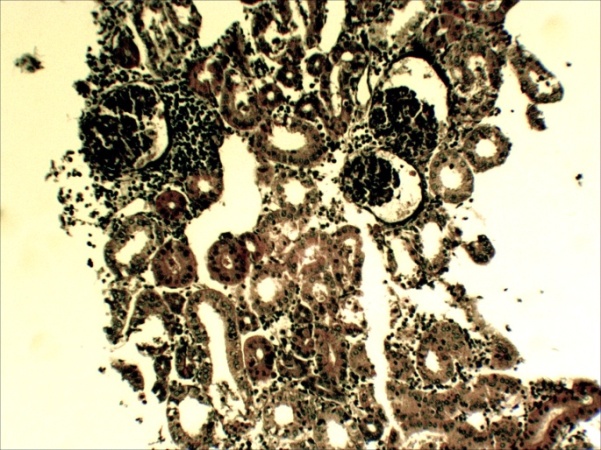
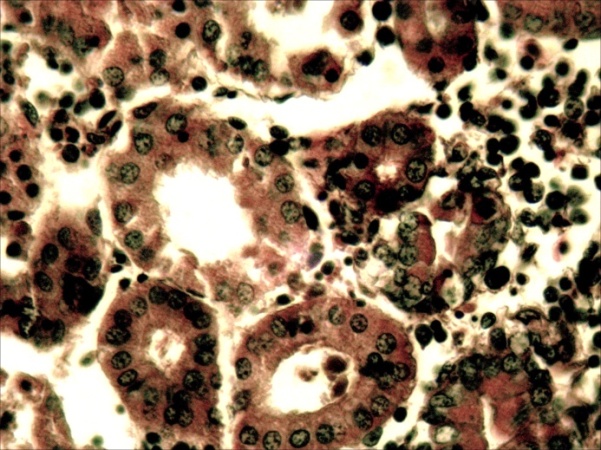
В печени четко выражена жировая и гидропическая дистрофия, некроз гепатоцитов, проявляющийся в виде маргинации хроматина, кариопикноза, деформации клеток и дискомплексации печёночных балок (рисунок 9, 10). В почках наблюдали экссудативный гломерулонефрит, проявлявшийся скоплением зернистого детрита (экссудата) в капсуле клубочков и в просвете канальцев, в большинстве канальцев – выраженный некротический некроз (некронефроз), выражающийся кариопикнозом и некрозом эпителия, деформацией канальцев,в эпителии отдельных канальцев гиалиново- капельная дистрофия, (рисунок 11,12).
 | 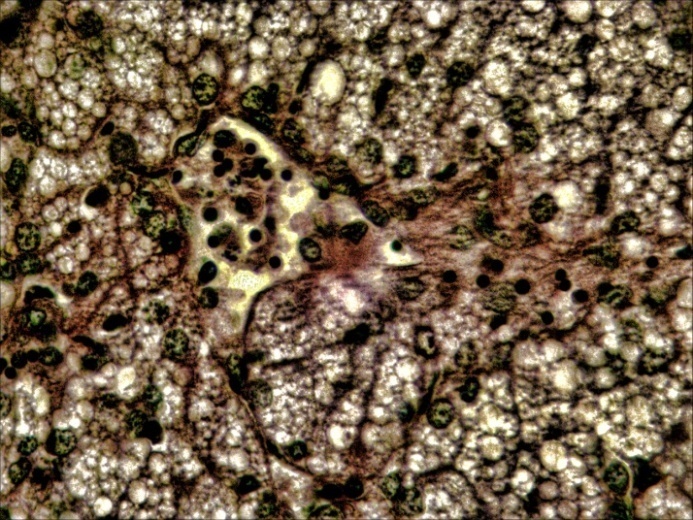 |
| А | Б |
Рисунок 9 – Печень: вакуольная дистрофия (А – об. х10) и кариопикноз в гепатоцитах (Б – об. х40) Г.Э.
 |  |
| А | Б |
Рисунок 10 – Печень. Некроз гепатоцитов (А – об. х90), Г.-Э. Жировая и гидропическая дистрофия гепатоцитов (Б – об. х40 окраска Судан III).
 |  |
| А | Б |
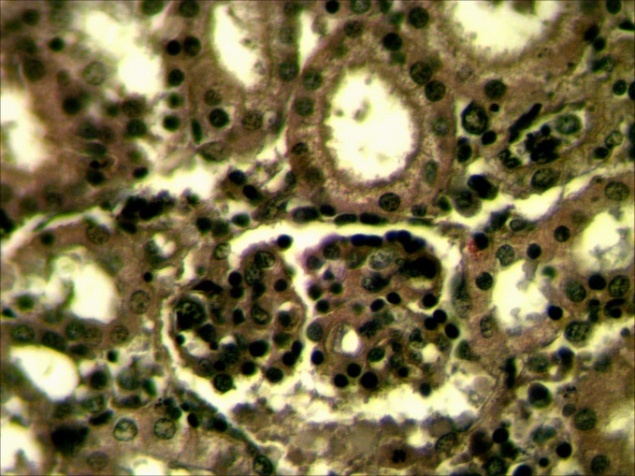
Рисунок 11 – Почки. Экссудативный гломерулонефрит-скопление экссудата в капсуле клубочка и канальцев, некронефроз. А – об. х10; Б – об. х40.Г.Э
 |  |
| А | Б |
Рисунок 12 – Почки. Некронефроз: дистрофия и некроз эпителия момевых канальцев, деформация канальцев, скопление детрита в их просвете, некроз эпителия. А – об. х40; Б – об. х100. Г.Э.
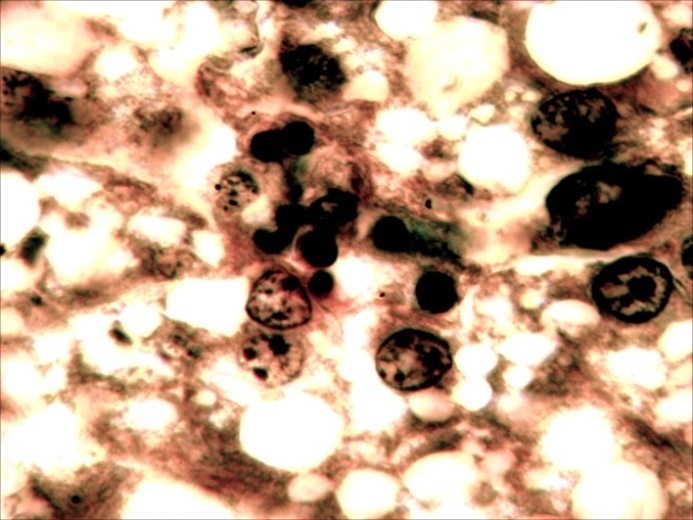
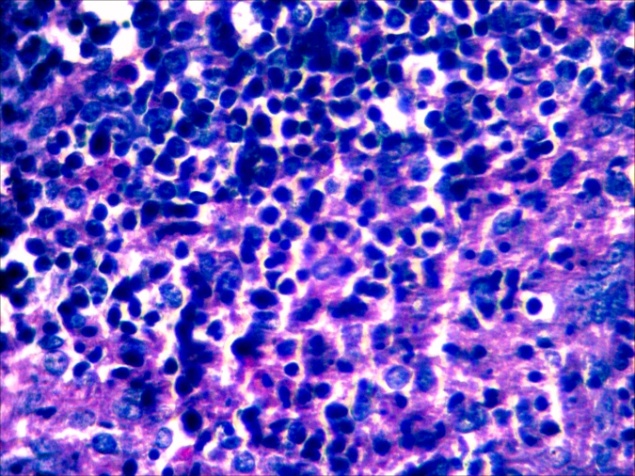
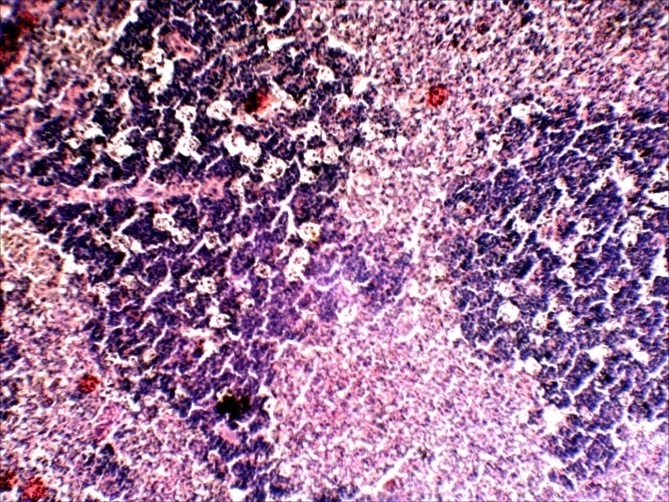
В селезёнке отмечалась гиперплазия лимфоидной ткани, повышенная концентрация лимфоидных и ретикуло-гистиоцитарных клеток, что является проявлением плазмоцитарной реакции (рисунок 13).
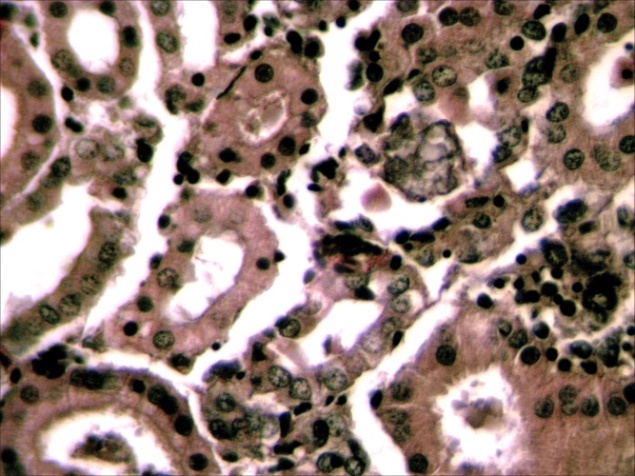
 |  |
| А | Б |
Рисунок 13 – Селезенка. Гиперплазия лимфоидной ткани, очаговая инфильтрация пульпы плазмоцитами и др.лимфоидными клетками. А –об. х10; Б – об. х40. Г.Э.
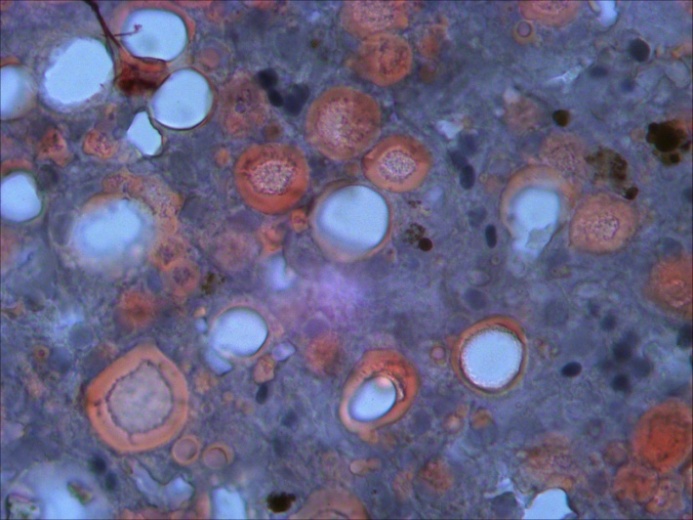
В заднем отделе кишечника – спиральной кишке выраженный десквамативный катар, сопровождающийся обширной десквамацией и распадом покровного эпителия слизистой оболочки (рисунок 14).
Рисунок 14 – Спиральная кишка: десквамативный катар, распад покровного эпителия. Об. х4. Г.Э.
2.1.5 Заключение по результатам опыта 1.
Полученные нами результаты показывают, что мальки русского осетра обладают довольно высокой чувствительностью к герпесвирусу сибирского осетра. От заболевших рыб исходный герпесвирус выделен в первом пассаже, что свидетельствует о его высокой вирулентности для русского осетра. Это можно объяснить не только видовыми особенностями, но и ослаблением организма подопытных мальков в результате слишком длительной транспортировки – транспортного стресса.
Герпесвирусная инфекция мальков русского осетра отличается острым течением, высокой летальностью, проявляется тяжелыми патоморфологическими изменениями. Из них наиболее характерны дистрофические и некротические изменения в кожном покрове и печени, экссудативный гломерулонефрит и некроз эпителия почечных канальцев, катаральное воспаление в спиральной кишке, а также четко выраженная гиперплазия лимфоидной ткани в селезенке и изменения лейкограммы в сторону преобладания фагоцитирующих форм – нейтрофилов, моноцитов, плазмобластов, лимфоидных и плазматических клеток. Вышеуказанные результаты: эпизоотологические данные, клинические и патоморфологические изменения следует использовать для установления предварительного диагноза болезни у русского осетра, постановки биопробы и разработки профилактических мероприятий.
2.2 Опыт 2. Заражение герпесвирусом мальков сибирского осетра
Опыт поставлен на мальках сибирского осетра (67 экз., в т.ч. контроль 30 и опыт 37 экз.) возрастом около 1 месяца, средней массой 8 г, доставленных автотранспортом из Вологодской обл., (г. Череповец, около 350 км). Перед постановкой опыта у них обнаружено вирусоносительство: герпесвирус выделен из смешанной пробы органов мальков в 3-м пассаже. Однако, в дальнейшем при исследовании контрольных рыб в данном опыте герпесвирус у них больше не выделялся.
Течение, симптомы и патолого-морфологические изменения у подопытных мальков.
Обобщенные данные о сроках проявления инфекции, динамике развития клинических признаков и гибели рыб представлены в таблице 5,6.
Таблица 5 – Динамика развития клинических признаков болезни у мальков сибирского осетра
Таблица 6 – Кумулятивная гибель заболевших мальков, n = 37
| Количество дней с момента заражения | 23 | 27 | 36 | 45 | 51 |
| Кумулятивная гибель, экз/% | 1/2,7 | 6/16,2 | 22/59,4 | 29/78,3 | 37/100 |
Из таблицы 5 видно, что инкубационный период длился 11 суток: у отдельных рыб появились неспецифические симптомы: угнетение, отказ от корма, ослабление реакций, белые пятна на поверхности тела. Гибель мальков (таблица 6) началась на 23 сутки после заражения, постепенно усиливалась и на 51 сутки достигла 100%. Рыбы погибали с признаками язвенных поражений кожи, осложненных сапролегниозом, очагового некротического распада плавников, энофтальма. У небольшой части подопытных рыб болезнь протекала со слабо выраженными симптомами или бессимптомно.
2.2.1 Результаты гематологических исследований.
Как видно из таблицы 7, у подопытных рыб относительно контроля, отмечено снижение уровня гемоглобина на 13% и увеличение количества эритроцитов на 25,6%, с параллельным снижением концентрации гемоглобина в эритроцитах (СГЭ).
Таблица 7 – Показатели крови сибирского осетра при заражении герпесвирусом
| Показатели крови | Группы | |
| Контроль | Опыт | |
| Гемоглобин, г/л | 21,59±6,55 | 18,78±3,87 |
| Эритроциты, 10 12 /л | 0,321±97,94 | 0,402±78,47+25,6% |
| СГЭ, пг | 67,89±9,11 | 45,41±10,95 |
| Всего молодых эритроцитов, % | 28,15±7,57 | 18,4±6,4-34,6% |
| Лейкоциты, тыс./мкл | 16,34 ±7,78 | 19,54±1,32+19,6% |
| Нейтрофилы, % | 21,50 ±7,5 | 28,5±14,5+32,5% |
| Моноциты, % | 4,50±1,5 | 0,67±0,5-86,2% |
| Лимфоциты, % | 70,0±9,0 | 70,6±12,4 |
В лейкоцитарной формуле количество лейкоцитов увеличено на 19,6 %, нейтрофилов – на 32,5% и значительно снижен процент моноцитов. Эти данные указывают на то, что герпесвирус вызывает лейкоцитоз и нейтрофилию, но несколько угнетает фагоцитарную активность свободных макрофагов – моноцитов. Однако при гистологическом исследовании отмечена значительная гиперплазия лимфоидной ткани селезенки, что указывает на активизацию тканевых фагоцитарных элементов ретикулоэндотелиальной системы (РЭС) – гистиоцитов, лимфоидных клеток и др.
2.2.2 Результаты патоморфологических исследований.
Патологоанатомические изменения проявлялись примерно так же, но менее ярко выражены, чем у русского осетра. На наружных покровах обнаруживались в основном точечные кровоизлияния на коже в основании жучек и на нижней поверхности брюшка, очаговый распад кончиков плавников, покраснение и выпячивание ануса. Печень бледная серо-белого цвета, размягчена, селезенка с бледными пятнами на поверхности, задний отдел кишечника заполнен густой слизью, слизистая оболочка пятнисто гиперемирована.
2.2.3 Гистологические изменения.
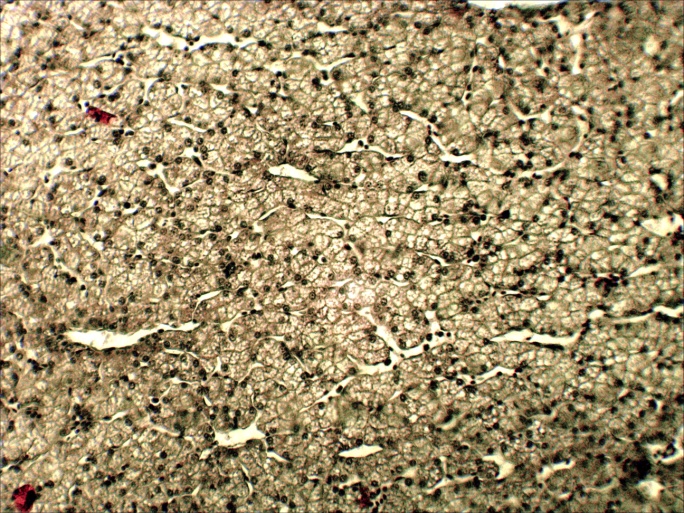
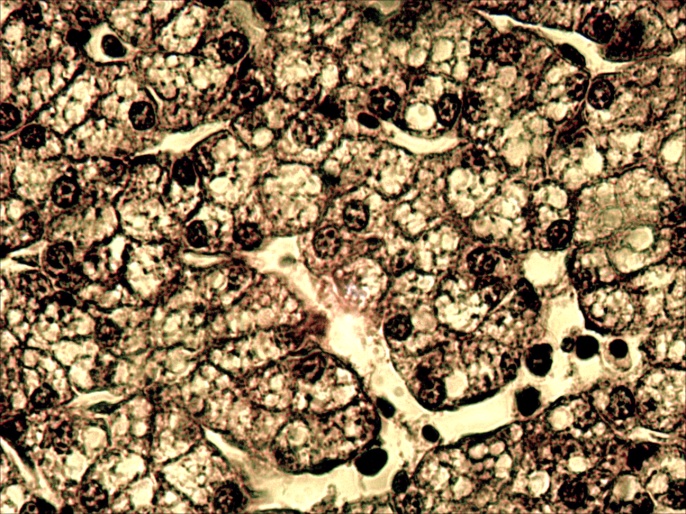
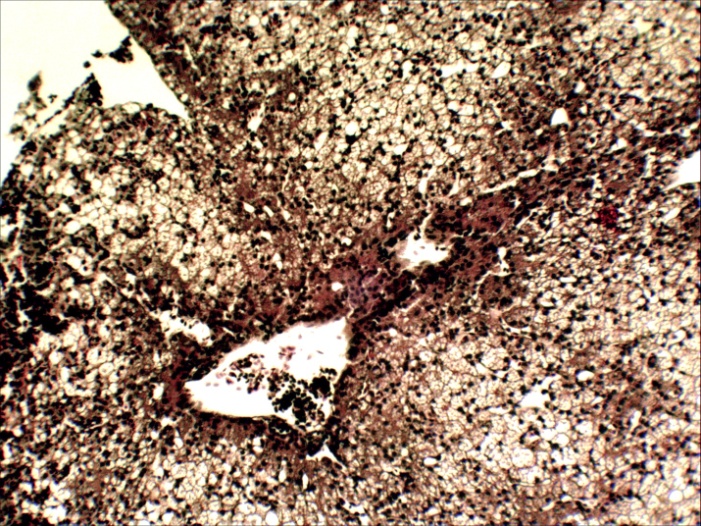
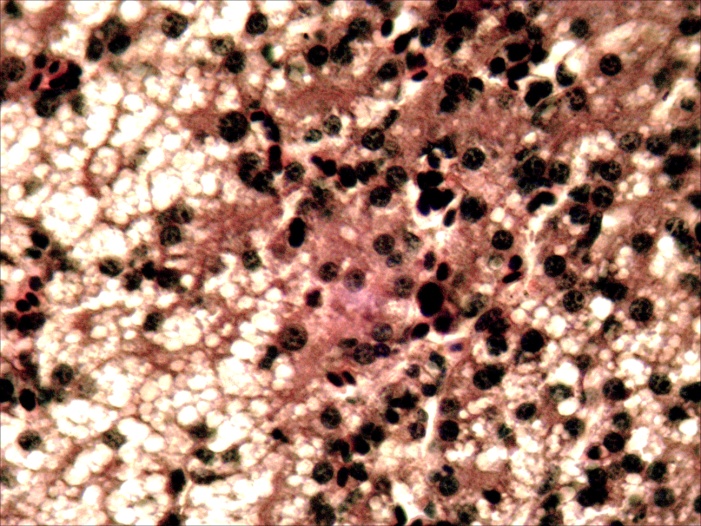
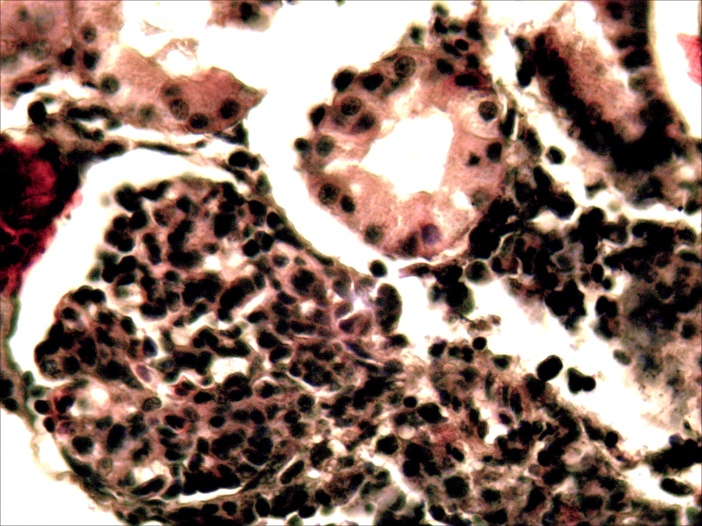
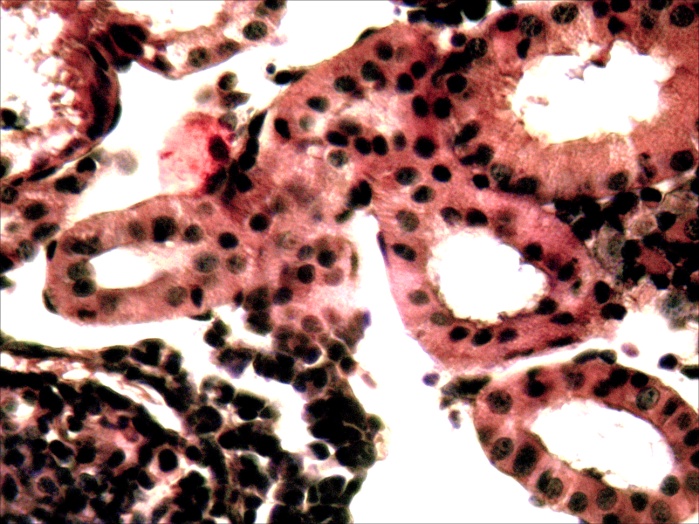
Микроструктурные изменения в кожном покрове и во внутренних органах больных мальков по своему характеру были такими же, как у русского осетра, но несколько отличались по глубине и тяжести проявления. На коже они проявлялись в виде очагового некроза и десквамации эпидермиса в области жучек (рисунок 8). В печени четко выражена жировая и гидропическая дистрофия, очаговый некроз гепатоцитов, проявляющиеся сильно выраженной вакуолизацией цитоплазмы гепатоцитов, кариопикнозом, деформацией клеток и дискомплексацией печёночных балок (рисунок 15, 16). В почках наблюдали экссудативный гломерулонефрит, проявлявшийся скоплением экссудата в полости капсулы клубочков ив просвете канальцев, в отдельных канальцах гиалиново капельная дистрофия эпителия, в остальных некротический нефроз-кариопикноз и некроз эпителия (рисунок 17). В селезёнке и эпикарде сердца отмечалась крупноочаговая гиперплазия лимфоидной ткани, повышенная концентрация лимфоидных и ретикуло-гистиоцитарных клеток, что является проявлением плазмоцитарной реакции (рисунок 18). В заднем отделе кишечника – спиральной кишке выраженный десквамативный катар, сопровождающийся обширной десквамацией и распадом покровного эпителия слизистой оболочки, как и в опыте 1 (рисунок 14).
 |  |
| А | Б |
Рисунок15 – Печень малька контрольной группы: А – об. х10 Б – об. х40. Г.Э.
 |  |
| А | Б |
Рисунок16 – Печень заболевших рыб: очаговая гидропическая дистрофия и некроз печеночных клеток, деструкция паренхимы. А об. х10, Б об. х40. Г.Э.
 |  |
| А | Б |
Рисунок17 – Почки: экссудативнй гломерулонефрит (А) и некронефроз канальцев (А, Б). Об. х40. Г.Э.
 |  |
| А | Б |
Рисунок 18 – селезенка (А): очаговая гиперплазия лимфоидной ткани, сердце (Б): гиперплазия и частичное запустение лимфоидных узелков в эпикарде. Об. х10. Г.Э.
2.2.4 Заключение по опыту 2
По результатам опыта видно, что мальки сибирского осетра оказались более устойчивыми к заражению герпесвирусом, чем мальки русского осетра: инкубационный период был более длительный, симптомы болезни и гибель появились позже (через 11-23 дня) и продолжались намного дольше (с 23 по 51 день, а в опыте 1- с 8 по 18 день). У русского осетра болезнь проявлялась более выраженными некротическими изменениями в печени и почках, а также снижением количества лейкоцитов и существенными изменениями в лейкограмме, указывающими на усиление фагоцитарной активности клеток крови и РЭС. Это свидетельствует о более тяжелом течении болезни у русского осетра, которое может быть связано, с одной стороны, с ослаблением резистентности организма рыб в результате более длительной транспортировки (на расстояние около 1100 км) по сравнению с перевозкой сибирского осетра на расстояние 350 км., и другой – сего видовыми особенностями. Отсюда вытекает вывод о том, что для профилактики болезни следует избегать длительные перевозки молоди осетров на дальние расстояния.
2.3 Опыт 3. определение профилактической эффективности витамина C
1-ый вариант – кормление рыб без применения витамина С:
контроль 1 – рыбы не зараженные герпесвирусом;
опыт 1 – рыбы, зараженные герпесвирусом.
2-ой вариант – кормление рыб с добавлением витамина С:
контроль 2 – рыбы, не зараженные герпесвирусом (30 экз.);
опыт 2 – рыбы, зараженные герпесвирусом (30 экз.).
В обоих вариантах опыта рыб кормили осетровым комбикормом марки Лимкорм (помол № 1,5 мм) два раза в сутки, дозировали по поедаемости корма рыбами. Дозу витамина С для второго варианта эксперимента брали из расчета 1 г витамина на 1 кг корма. Необходимое количество витамина С растворяли в небольшом объеме воды и опрыскивали этим раствором навеску корма, рассчитанную на одни сутки. Затем подсушивали при комнатной температуре и скармливали рыбам. Каждый день готовили свежую порцию корма с витамином.
Витаминным кормом рыб кормили в течение 7 дней до заражения и 3-х дней после заражения герпесвирусом, затем скармливали обычный корм. Таким образом, курс кормления витамином С составил 10 дней. Рыбам в контроле 2 аналогичный корм задавали по той же схеме, но герпесвирусом не заражали.
Каждая группа рыб размещалась в отдельном аквариуме объемом 70 л. Опыт ставили на проточной артезианской воде при температуре 15-17 о С. Для заражения рыб использовали изолят герпесвируса SK/1114. Рыб заражали методом ванн в течение 1 часа с конечной концентрацией вируса в воде 10 4 ТЦД50/мл. В течение всего опыта длительностью 60 дней вели ежедневные клинические наблюдения и учёт гибели рыб.
Патологический материал для вирусологических и гистологических исследований отбирали на 4-е сутки после заражения, а также в период явного проявления болезни от погибающих и свежее погибших рыб.
Гематологические исследования во всех группах проведены через 4 дня после заражения рыб.
При сравнении результатов 1 и 2 вариантов опыта установлено, что витамин С оказал определенный профилактический эффект – способствовал повышению устойчивости рыб к заражению герпесвирусом.
Спустя 34 – 35 суток после заражения у подопытных мальков было отмечено улучшение аппетита, они стали более подвижными, бледных пятен стало меньше и на 60 сутки после заражения они остались только у 5 рыб (16,6%). Однако больные рыбы данной группы сильно отставали в росте по сравнению с рыбами контрольных групп. На 60 сутки после заражения средняя масса мальков в опыте (2 вариант) была в 2 раза меньше средней массы рыб контрольных групп.
Результаты гематологических исследований подопытных и контрольных рыб представлены в таблице 8.
Таблица 8 – Гематологические показатели у мальков сибирского осетра при применению витамина С
| Показатели крови | Вариант 1 | Вариант 2 (с витамином С) | ||
| Контроль 1 | Опыт 1 (зараженные) | Контроль 2 | Опыт 2 (зараженные) | |
| Гемоглобин, г/л | 21,59±6,55 | 18,78±3,87 | 23,57±4,27 | 19,88±4,98 |
| Эритроциты, 10 12 /л | 0,321±0,097 | 0,402±0,078 | 0,367±0,068 | 0,411±0,039 |
| СГЭ, пг | 67,89±9,11 | 45,41±10,95 | 64,40±4,15 | 49,10±13,79 |
| Всего молодых эритроцитов, % | 28,15±7,57 | 18,4±6,4 | 31,55±0,92 | 27,4±4,2 |
| Лейкоциты, тыс./мкл | 16,34±7,78 | 19,5±1,32 | 11,77±0,11 | 33,09±6,05 *Н |
| Нейтрофилы, % | 21,50±6,5 | 26,67 ±14,5 | 23,00±2,83 | 39,50±12,5+71,1% |
| Моноциты, % | 4,50±1,5 | 0,67 ±0,5 | 1,0 ±0,8 | 3,0 ±2,0 |
| Лимфоциты, % | 70,0±9,0 | 70,67 ±12,4 | 74,5±2,12 | 62,00 ±9,0 |
В опыте 1 (1-ый вариант), относительно контроля 1, отмечено снижение уровня гемоглобина на 13% и увеличение количества эритроцитов на 9,5%, с параллельным снижением концентрации гемоглобина в эритроцитах (СГЭ). В лейкоцитарной формуле количество лейкоцитов увеличено на 20 %, нейтрофилов – на 24%
Во втором варианте опытов у мальков сибирского осетра, которым скармливали витамин С, показатели количества эритроцитов и гемоглобина сходны с таковыми рыб, получавших корм без витамина С. В лейкоцитарной формуле у заражённых рыб (опыт 2) в сравнении с контролем 2 выявлено значительное увеличение общего количества лейкоцитов (в 3 раза), нейтрофилов на 69,8 %, моноцитов в 3 раза. Это указывает на значительную активизацию гемопоэза и фагоцитарной активности разных групп лейкоцитов.
Заключение по опыту 3
Результаты исследований показали, что витамин С в испытанной дозировке оказал профилактический эффект против герпесвирусной болезни.
Профилактический эффект выражался ослаблением клинического течения и низкой смертностью рыб, а также повышением общей резистентности и иммунологической реактивности организма подопытных рыб, о чём свидетельствует активная выработка фагоцитирующих клеток крови (моноцитов, нейтрофилов) у зараженных рыб.
Полученные результаты могут быть использованы для обоснования практического использования витамина С для профилактики герпесвирусной болезни осетровых рыб, а также для разработки методов его применения.
2.4 Опыт 4. Определение патогенности миксобактерий и аэромонад для сеголеток осетровых рыб
Опыт проведен на тех же мальках сибирского осетра, подрощенных до средней массы 15г (сеголетки), в 2-х вариантах.
В первом варианте эксперимента провели заражение рыб: в одной группе миксобактериямии во второй аэромонадами методом ванн.
В первой группе заражение рыб проводили музейными культурами миксобактерий (флексибактерий), выделенных ранее из воды стоячего водоема. Культуру для заражения выращивали на среде Сабуро из 3-х колоний. В воде опытного аквариума с температурой 17°С создали концентрацию клеток миксобактерий 10000 КОЕ/мл. Затем в аквариум для заражения посадили 20 сеголеток сибирского осетра, которых выдерживали 2 часа при аэрации воды. После процедуры заражения рыб аквариум заполнен чистой водой, включена проточность воды и продолжалось ежедневное наблюдение в течение 15 дней. В течение этого срока у подопытных рыб не обнаружено признаков заболевания и отсутствовала гибель.
Во второй группе при проведении аналогичного опыта с использованием аэромонад (A. veronia) подопытные рыбы также не заболели. Полученные результаты обеих биопроб показали, что испытанные культуры миксобактерий и аэромонад при перкутанном заражении рыб через воду оказались авирулентными и не вызвали заболевание молоди сибирского осетра.
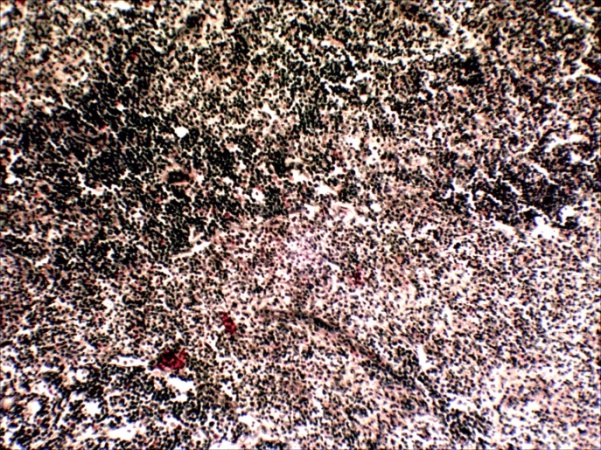
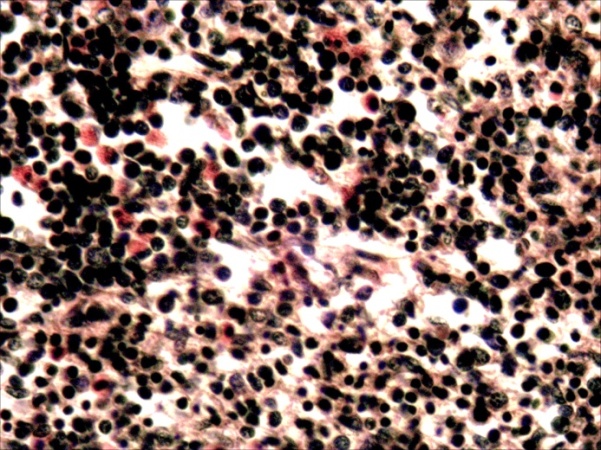
Во втором варианте подопытных рыб заражали вирулентным штаммом аэромонад (A. veronia) внутримышечно в дозе 0,1 мл. В данном случае через 2-3 дня после заражения все подопытные рыбы заболели и погибли. При бактериологическом исследовании от них выделена исходная культура аэромонад. По результатам патогистологических исследований у них установлены характерные признаки септицемии: обширные дистрофические и некротические изменения: в печени тотальная гидропическая дистрофия и некроз гепатоцитов; в почках экссудативнй гломерулонефрит, некротический нефроз и распад гемопоэтической ткани; в селезенке – гиперплазия лимфоидной ткани, массивная инфильтрация паренхимы лейкоцитами, их распад; воспалительные поражения жабр, скелетной мускулатуры и др. (рисунок 19, 20, 21, 22).
 |  |
| А | Б |
Рисунок 19 – Печень: тотальная гидропическая дистрофия и некроз паренхимы. А – об. х10, Б – об. х40. Г.Э.
 |  |
| А | Б |
Рисунок 20 – Почки: экссудативный гломерулонефрит, некронефроз, резкое уменьшение гемопоэтической ткани (А – об. х10); некронефроз канальцев, распад клеток гемопоэтической ткани (Б – об. х40). Г.Э.
 |  |
| А | Б |
Рисунок 21 – Почки: слабее выражены гломерулонефрит и дистрофия эпителия мочевых канальцев, резкое уменьшение гемопоэтической ткани. А – об. х10, Б – об. х40. Г.Э.
 |  |
| А | Б |
Рисунок 22 – Селезенка. Гиперплазия лимфоидной ткани, тотальная инфильтрация пульпы лейкоцитами, лимфоидными клетками, плазмоцитами и другими элементами РЭС. (А – об. х10), клетки инфильтрата: эозинофильные гранулоциты, лимфоциты, гистиоциты, многие из них в состоянии распада (Б – об. х40). Г.Э.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований получены новые данные о возрастной восприимчивости к заражению герпесвирусом осетров на ранней стадии развития, подробно изучены особенности течения и проявления герпесвирусной болезни, выявлены наиболее характерные клинические признаки, гематологические показатели и патолого-морфологические изменения, рекомендуемые для использования при диагностике заболевания. На основе комплексного анализа вышеуказанных результатов и материалов предыдущих исследований нами сделаны следующие выводы.
1. Впервые установлено, что мальки русского и сибирского осетра возрастом до 1-го месяца массой 5-6 г, как и сеголетки 2-6-и месячного возраста, чувствительны к герпесвирусной болезни, их можно использовать в качестве тест — объектов для постановки биопроб при диагностике заболевания.
2. Мальки русского осетра оказались чувствительны к заражению герпесвирусом, заболевание у них протекало тяжело и сопровождалось гибелью в короткие сроки. Это можно объяснить не только видовыми особенностями, но и ослаблением организма подопытных мальков в результате более длительной транспортировки – транспортного стресса.
3. Заболевание проявлялось комплексом клинических признаков и патолого-морфологических изменений. Из них наиболее выражены: точечные или пятнистые кровоизлияния, очаговый некроз эпидермиса на разных участках кожного покрова; дистрофические и некротические поражения в паренхиме печени; экссудативный гломерулонефрит и некротический нефроз в почках; катаральный энтерит в спиральной кишке; гиперплазия лимфоидной ткани в селезенке и сердце, а также изменения лейкограммы в сторону увеличения процента нейтрофилов, моноцитов, лимфоидных и плазматических клеток.
4. В целом проведённые исследования показывают, что клинико-анатомическая картина при герпесвирусной болезни достаточно характерна. Она вызывает существенные патологические изменения не только в кожных покровах, но и во внутренних органах, то есть имеет генерализованный характер, что подтверждается данными вирусологических исследований.
5. В связи с частым осложнением флексибактериозом, сапролегниозоми другими инфекциями (аэромонозом, псевдомонозом) герпесвирусная болезнь может затушевываться симптомами данных заболеваний [3]. В поставленном нами опыте 4 установлены возможные условия и пути заражения рыб этими бактериями и проявление аэромоноза у молоди осетровых. Отрицательные результаты заражения рыб этими бактериями перкутанно через воду и острое проявление септицемии при внутримышечном заражении аэромонадами косвенно указывает на то, что основной причиной осложнения герпесвирусной болезни этими инфекциями является повреждение вирусом целостности кожного покрова и тем самым открытие ворот для проникновения условно патогенной микрофлоры.
6. Диагностику герпесвирусной болезни следует проводить комплексно на основании анализа эпизоотологических данных, клинических признаков и патолого-морфологических изменений. Окончательный и дифференциальный диагноз должен подтверждаться данными лабораторных исследований (вирусологических, бактериологических и др.). Выделение и идентификацию вируса следует проводить на чувствительных культурах клеток (SSO-2, WSS-2), полученных из тканей осетровых рыб.
7. В опыте 3 по изысканию методов профилактики герпесвирусной болезни показано, что применение витамина С в дозе 1г на кг корма в течение 10 дней снижает заболеваемость и гибель рыб от данной болезни. т.е. оказывает профилактический эффект.
Выводы и практические предложения нашли отражение в научных статьях и изданиях:
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Головин П.П., Головина Н.А., Романова Н.Н., Корабельникова О.В. Испытание в аквакультуре биологически активных препаратов, повышающих иммунофизиологический статус рыб // Рыбное хозяйство. – 2008. — № 4. – С. 63-66.
Головин П.П., Головина Н.А., Романова Н.Н. Кадастр лечебных препаратов, используемых и апробированных в аквакультуре России и за рубежом. – М.: ФГНУ «Росинформагротех», 2005. – 56с.
Грищенко Л.И., Гончарова М.Н. Эпизоотология и меры борьбы с флексибактериозами рыб с применением препарата антибак //Материалы междунар. учебно-методич. и науч.-практич. конф. конф. – М.: МГАВМиБ, 2004. Ч.1. – С. 319-322.
Грищенко Л.И., Акбаев М.Ш. Болезни рыб с основами рыбоводства: учебник для вузов. – М.: КолосС, 2013.– 479 с.
Грищенко Л.И., Елеев Э.Л., Заботкина Е.А. Гистологические изменения при герпесвирусной инфекции осетровых рыб // Российский ветеринарный журнал. СХЖ. – 2015. — № 4. – С. 20-21.
Грищенко Л.И., Елеев Э.Л. Герпесвирусные болезни рыб: распространение, течение, диагностика и профилактика // Российский ветеринарный журнал. СХЖ. – 2018.- №1. – С.22-28.
Елеев Э.Л., Грищенко Л.И., Пономарев В.Н., Калабекова Ф.С. Клиниические признаки и патологоанатомические изменения при герпесвирусной инфекции гибрида русского и сибирского осетров // Российский ветеринарный журнал. СХЖ. – 2014. — №1. – С. 19-21.
Елеев Э.Л. Особенности течения герпесвирусной болезни сибирского осетра, вызванной изолятом SIZ6/0311 // Сб. научн.тр. междунар. учебно-методич. и научно-практич. конференции «Актуальные проблемы ветеринарии, зоотехнии и биотехнологии». – М.: 2014. – С. 139-141.
Елеев Э.Л., Грищенко Л.И., Заботкина Е.А., Погомарев В.Н. Патоморфологические изменения при герпесвирусной инфекции осетровых рыб // Расширенные материалы 1V Междунар. конф. «Проблемы иммунологии, патологии, охраны здоровья рыб и др.гидробионтов». – Борок-Москва. – 2015. – С. 512-516.
Елеев Э.Л., Грищенко Л.И., Заботкина Е.А. Герпесвирусная инфекция осетровых рыб: патоморфология, патогенез и диагностика болезни // М.: Труды ВНИРО. – 2016. — Т. 162. – С. 116 – 127.
Степанов М.И., Архипов Г.С. Особенности использования витаминов и эссенциальных микроэлементов для лечения и профилактики рецидивов простого герпеса // Фундаментальные исследования. – 2012. – № 7-2. – С. 456-462. – URL: http://fundamental-research.ru/ru/article/view?id=30164 (дата обращения: 25.09.2019).
Щелкунов И.С., Щелкунов Т.И., и др. Герпесвирусная болезнь осетровых рыб в России // Российский ветеринарный журнал СХЖ. – 2007. — №1. – С.10.
Щелкунов А.И., Щелкунов И.С. Герпесвирусная болезнь сибирского осетра // Ветеринария. – 2010. — №1 – С. 18-21.
Hendrick R.P. McDowell T.S., Groff J.M. Isolation of epitheliotropic herpesvirus from white sturgeon Acipenser transmontanus // Dis aqatic organisms. – 1991.-Vol.11. – Р. 49-51.