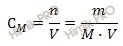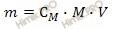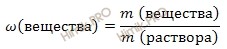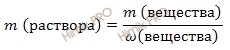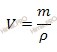10 процентный раствор серной кислоты как приготовить
10 процентный раствор серной кислоты как приготовить
Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе
Reagents. Methods for preparation of accessory reagents and solutions used for analysis
____________________________________________________________________
Текст Сравнения ГОСТ4517-87 с ГОСТ 4517-2016 см. по ссылке.
— Примечание изготовителя базы данных.
____________________________________________________________________
Дата введения 1988-07-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 29.10.87 N 4093
3. Стандарт полностью соответствует стандарту СЭВ 435-86
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
2.7.1; 2.22.1; 2.51.1; 2.73.1; 2.82.1; 2.140.1; 2.141.1; 2.158.1
6. ПЕРЕИЗДАНИЕ. Май 2008 г.
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления вспомогательных реактивов, растворов и смесей, применяемых при анализе химических реактивов.
1.1. При приготовлении растворов следует соблюдать требования ГОСТ 27025.
1.2. При приготовлении растворов применяют мерную лабораторную стеклянную посуду (цилиндры, мензурки, колбы, пробирки) по ГОСТ 1770;
стеклянные холодильники по ГОСТ 25336;
тигли, чашки, стаканы, воронки, пробирки из прозрачного кварцевого стекла по ГОСТ 19908;
чашки, тигли фарфоровые, стаканы фарфоровые, воронки Бюхнера (фарфоровые) по ГОСТ 9147;
фильтровальную лабораторную бумагу по ГОСТ 12026;
посуду и оборудование лабораторные стеклянные по ГОСТ 25336;
ареометры общего назначения для измерения плотности жидкости;
весы лабораторные общего назначения по ГОСТ 24104*.
1.3. Для приготовления вспомогательных реактивов и растворов применяют реактивы, указанные в нормативно-технической документации (приложение 1).
1.4. Для приготовления растворов применяют реактивы квалификаций химически чистый и чистый для анализа.
При необходимости перед приготовлением растворов реактивы измельчают. Готовые растворы перемешивают и при наличии мути, осадка, хлопьев фильтруют. Фильтрацию проводят, если нет специальных указаний, через обеззоленный фильтр «синяя лента», промытый горячей водой.
1.5. При использовании растворов, хранившихся длительное время, следует убедиться в отсутствии опалесценции, осадка, хлопьев. В противном случае растворы фильтруют или заменяют свежеприготовленными.
1.6. Растворы реактивов хранят в стеклянной посуде с притертыми пробками или в полиэтиленовых флаконах с навинчивающимися крышками при температуре 15-25 °С (если нет других указаний).
1.7. Работу с огнеопасными, взрывоопасными, ядовитыми и летучими веществами проводят в соответствии с требованиями безопасности.
2. ПРИГОТОВЛЕНИЕ ВСПОМОГАТЕЛЬНЫХ РЕАКТИВОВ И РАСТВОРОВ
2.1. Альдегид салициловый, раствор с массовой долей приблизительно 1% в метаноле
0,10 г салицилового альдегида растворяют в 10,0 см метанола.
Раствор хранят в темном прохладном месте в течение 6 мес. Следует применять только бесцветный раствор.
2.2. Алюминон, раствор с массовой долей приблизительно 0,1%
0,10 г алюминона (C H N O ) растворяют в 100 см воды.
2.3. Амальгама цинка (для восстановления)
2.3.1. Реактивы и растворы
Кислота серная, раствор с массовой долей 5%.
Цинк металлический гранулированный.
Около 3 г цинка нагревают в течение 10 мин на водяной бане в фарфоровой чашке со 100 г ртути и с 3-5 см раствора серной кислоты и затем охлаждают. Амальгаму тщательно промывают водой и в делительной воронке отделяют от твердых кусков сплава ртути и цинка.
Амальгаму цинка готовят под тягой.
Оставшийся в делительной воронке твердый конгломерат цинка и ртути сохраняют, затем снова используют, периодически прибавляя его к отработанной амальгаме.
2.4. Аммиак водный, раствор с массовой долей 10%
2.5. Аммиак водный, раствор с массовой долей 25%, не содержащий углекислоты
2.5.1. Приготовление из газообразного аммиака
2.5.1.1. Реактивы и растворы
Вода дистиллированная, не содержащая углекислоты; готовят в соответствии с п.2.38.
Натрия гидроксид (натрия гидроокись), раствор с массовой долей 50%; готовят в соответствии с п.2.102.
2.5.2. Приготовление из водного аммиака
2.5.2.1. Реактивы и растворы
Аммиак водный, раствор с массовой долей 25%.
Вода дистиллированная, не содержащая углекислоты; готовят в соответствии с п.2.38.
Кальция оксид (кальция окись).
2.6. Аммония ацетат, раствор с массовой долей 10%
10,0 г ацетата аммония (CH COONH ) растворяют в 90 см воды.
Реактивы и техника приготовления растворов
Процентным раствором называют раствор, содержащий в своем составе определенный процент вещества по массе пли объему. Например, 50%-ный раствор NaOH содержит 50 г химически чистого NaOH в 100 г раствора (процент к массе) или 60%-ный раствор спирта содержит 60 мл безводного спирта на 100 мл раствора.
Пример. Необходимо приготовить 1 л 5%-ного раствора НС1 при плотности 1,19.
По таблице узнаем, что 5%-ный раствор НС1 имеет плотпость 1,024. Тогда 1 л ее будет весить 1,024-1000=1024 г.
В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 содержит 37,23% НС1. Исходное вещество находим по таблице.
Чтобы узнать, сколько нужно взять кислоты, составляем пропорцию:
или
Таким же образом рассчитываем и серную кислоту.
Таблица 33
Исходное
вещество
Плотность
Весовой процент исходного вещества
1,19 1,84 1,40
37,23
634,8 167,7 313,0
496,6 129,9 243,6
236,8 60,6 115,0
115,5 29,3 56,0
45,5 11,5 22,0
22,6 5,6 10,8
Для облегчения расчета в таблице 33 приведено количество исходных веществ для приготовления процентных растворов кислот.
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Химик.ПРО – решение задач по химии бесплатно
Какой объем 96-процентного раствора серной кислоты (H2SO4) плотностью 1,84 г/мл потребуется для приготовления 3 литров раствора с концентрацией 2 моль/л?
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, получаем:
m (H2SO4) = 2 моль/л ∙ 98 г/моль ∙ 3 л = 588 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора серной кислоты (H2SO4):
m (раствора H2SO4) = 588 г/ 0,96 = 612,5 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 3 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
V (раствора H2SO4) = 612,5 г /1,84 г/мл = 332,88 (мл).
Ответ: объем раствора серной кислоты равен 332,88 мл.
Концентрация раствора
Концентрация раствора это относительное количество растворенного вещества в растворе.
Количественный состав раствора выражают с помощью понятия «концентрация» или “доля”, под которым понимают содержание растворенного вещества в единице массы, объёма или количества вещества раствора.
Существует несколько способов выражения состава раствора: массовая доля (процентная концентрация), молярная концентрация (молярность), мольная доля растворённого вещества.
Процентная (весовая) концентрация растворов
Весовая процентная концентрация показывает, какой процент от общего веса раствора составляет растворенное вещество.
В лабораторной практике часто приходится иметь дело с кристаллогидратами — солями, содержащими кристаллизационную воду, например CuSО4 ·5H2O, FeSО4 · 7H2О и т. д.
В этом случае следует уметь учитывать кристаллизационную воду.
Процентная концентрация растворов примеры решения задач
21. Сколько кристаллогидрата Na2SO4 · 10H2O понадобится для приготовления 2 кг 34 раствора Na2SО4?
22. Сколько кристаллогидрата железного купороса FeSO4·7H2O потребуется для приготовления 30 кг 0,5% раствора FeSO4?
23. Сколько кристаллогидрата CaCl2 · 6H2O потребуется для приготовления 500 г 10% раствора СаСl2?
24. Сколько кристаллогидрата ZnSO4· 7H2O потребуется для приготовления 400 г 0,1 % раствора ZuSО4? (См. Ответ)
Иногда приходится приготовлять растворы определенной процентной концентрации, пользуясь для этого другими, более концентрированными растворами.
Особенно часто с этим приходится сталкиваться в лаборатории при получении растворов кислот разной концентрации.
Определенная процентная концентрация
Вопросы для определения процентной концентрации
25. Сколько потребуется 80% фосфорной кислоты для приготовления 2 кг 5% раствора?
26. Сколько потребуется 20% щелочи для приготовления 5 кг. 1 % раствора?
27. Сколько потребуется 15% азотной кислоты для приготовления 700 г 5% раствора?
28. Сколько потребуется 40% серной кислоты для приготовления 4 кг 2% раствора?
29. Сколько потребуется 10% соляной кислоты для приготовления 500 г 0,5% раствора? (См. Ответ)
Приготовление растворов кислот
Однако произвести правильный расчет — это для лаборанта еще не все. Нужно уметь не только рассчитать, но и приготовить раствор кислоты.
Но кислоты нельзя взвешивать на весах, их можно только отмерять при помощи мерной посуды. Мерная же посуда предназначена для измерений объема, а не веса.
Поэтому нужно суметь вычислить объем найденного количества раствора. Этого нельзя сделать, не зная удельного веса (плотности) раствора.
Обратимся снова к примеру 3, видно, что 80% серная кислота имеет плотность d=1,7, а масса раствора Р =25 г. Следовательно, по формуле
Плотность воды практически считаем равной единице. Следовательно, 175 г воды займут объем 175 мл. Таким образом, чтобы приготовить 200 г 10% раствора из 80% серной кислоты, следует взять 175 мл воды и налить в нее 14,7 мл 80% серной кислоты.
Смешивание можно производить в любой химической посуде.
Вопросы для определения растворов кислот
30. Сколько миллилитров 50% серной кислоты следует взять для приготовления 2 кг 10% раствора этой кислоты?
31. Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
32. Сколько миллилитров 34% едкого кали потребуется для приготовления 10 л 10% раствора?
33. Сколько миллилитров 30% соляной кислоты потребуется для приготовления 500 мл 2% соляной кислоты? (См. Ответ)
Пример определения концентрации раствора
Примеры расчетов, которые мы разбирали до сих пор, были посвящены определению веса или объема раствора, а также количества вещества, содержащегося в нем.
Однако бывают случаи, когда нужно определить концентрацию раствора. Рассмотрим простейший случай.
Вопросы для определения концентрации раствора
34 Смешано 25 г соли и 35 г воды. Какова процентная концентрация раствора?
35. Смешано 5 г кислоты и 75 г воды. Какова процентная концентрация раствора? (См. Ответ)
Пример определения разбавленных, выпаренных растворов
Довольно часто приходится разбавлять, упаривать и смешивать растворы, после чего определять их концентрацию.
Вопросы для определения разбавленных, выпаренных растворов
36. К 2 кг 20% раствора прилили 500 г воды. Какой стала концентрация раствора?
37. К 5 а 36% соляной кислоты прилили 1 л воды. Какой стала концентрация раствора?
38. Смешали 40 кг 2% и 10 кг 3% растворов одного и того же вещества. Какой стала концентрация полученного раствора?
39. Смешали 4 л 28% серной кислоты и 500 мл 60% серной кислоты. Какова концентрация полученного раствора?
40. 3 кг 20% раствора едкого натра упарили до 2 кг. Какова концентрация полученного раствора?
41. Сколько воды нужно прибавить к 500 мл 30% раствора (плотность 1,224 г/см 3 ), чтобы получить 5% раствор? (См. Ответ)
Определение соотношение смешанных разных концентраций
Для определения, в каком соотношении следует смешать растворы разных концентраций, чтобы получить раствор искомой концентрации, можно применять так называемое «правило смешивания», или «диагональную
схему»
Вопросы для определения в каком соотношении нужно смешивать вещества
42. Рассчитайте по диагональной схеме, в каком соотношении следует смешать растворы:
а) 20% и 3% для получения 10%;
б) 70% и 17% для получения 25%;
в) 25% и воду для получения 6% (См. Ответ)
Объемная концентрация растворов Молярная концентрация
При определении объемной концентрации растворов расчеты производят применительно к 1 л раствора.
Молярная концентрация, например, показывает сколько грамм-молекул (молей) растворенного вещества содержится в 1 л раствора.
Например, если в 1л раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1 М), если 2 моля, то двумолярным (2 М), если 0,1 моля, тo раствор децимолярный (0,1 М), если 0,01 моля, то раствор сантимолярный (0,01 М) и т. д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
Молярная концентрация очень удобна тем, что в равных объемах растворов с одинаковой молярностью содержится одинаковое количество молекул, так как в грамм-молекуле любого вещества содержится одно и то же число молекул.
Готовят раствор молярной концентрации в мерных колбах определенного объема.
На шейке такой колбы имеется отметка, точно ограничивающая нужный объем, а надпись на колбе указывает, на какой объем рассчитана данная мерная колба.
Вопросы для определения объемная концентрация растворов, молярная концентрация
43. Рассчитайте, какое количество вещества требуется для приготовления следующих растворов:
а) 5 л 0,1 М раствора серной кислоты;
б) 20 мл 2 М раствора соляной кислоты;
в) 500 мл 0,25 М раствора сульфата алюминия;
г) 250 мл 0,5 М раствора хлорида кальция. (См. Ответ)
Пример решения процентных растворов
Растворы кислот молярной концентрации нередко приходится готовить из процентных растворов.
Вопросы для определения процентных растворов
44. Сколько потребуется 50% азотной кислоты для приготовления 500 мл 0,5 М раствора.
45. Какой объем 98% серной кислоты необходим для приготовления 10 л 3 М раствора?
46. Вычислите молярность следующих растворов:
а) 20% серной кислоты;
в) 10% азотной кислоты;
Нормальная концентрация растворов (эквивалент)
Нормальная концентрация растворов выражается количеством грамм-эквивалентов растворенного вещества в 1 л раствора.
Для того чтобы произвести расчет для приготовления раствора нормальной концентрации, нужно знать, что такое эквивалент. Слово «эквивалентный» означает «равноценный».
Эквивалентом называется весовое количество элемента, которое может соединяться с 1 весовой частью водорода или замещать ее в соединениях.
Если в молекуле воды Н2О содержится два атома водорода, весящих в сумме 2 у. е., и один атом кислорода, весящий 16 у. е., то на 1 у. е. водорода приходится 8 у. е. кислорода, что и будет эквивалентом кислорода.
Если мы возьмем какой-нибудь окисел, например закись железа FeO, то в нем водорода нет, но зато есть кислород, а мы нашли из предыдущего расчета, что 8 у. е. кислорода эквивалентны 1 у. е. водорода.
Следовательно, достаточно найти количество железа, способное соединиться с 8 у. е. кислорода, и это также будет его эквивалентом.
Атомный вес железа 56. В окисле 56 у. е. Fe приходится на 16 у. е. кислорода, а на 8 у. е. кислорода железа придется вдвое меньше.
Можно найти эквивалент и для сложных веществ, например для серной кислоты H2SО4.
В серной кислоте на 1 у. е. водорода приходится половина молекулы кислоты (включая, конечно, и водород), так как кислота двухосновная, т. е. эквивалент серной кислоты равен ее молекулярному весу (98 у. е.), деленному на 2, т. е. 49 у. е.
Эквивалент для оснований
Эквивалент для основания можно найти, разделив его молекулярный вес на валентность металла.
Например, эквивалент NaOH равен молекулярному весу (40 у. е.), деленному на 1, т. е. на валентность натрия. Эквивалент NaOH равен 40 у. е.
Эквивалент гидроокиси кальция Са(ОН)2 равен молекулярному весу (74 у. е.), деленному на валентность кальция, а именно на 2, т. е. 37 у, е.
Для того чтобы найти эквивалент для какой-нибудь соли, нужно молекулярный вес ее разделить на валентность металла и количество его атомов.
Так, молекулярный вес сульфата алюминия Al2(SO4)3 равен 342 у. е. Эквивалент его равен: 342 : (3 · 2) = 57 у.е. где 3 — валентность алюминия, а 2 — количество атомов алюминия.
■ 47. Рассчитайте эквиваленты следующих соединений; а) фосфорной кислоты; б) гидроокиси бария; в) сульфата натрия;г) нитрата алюминия. (См. Ответ)
Грамм-эквивалентом называется количество граммов вещества, численно равное эквиваленту.
Если в 1 л раствора содержится 1 грамм-эквивалент (г-экв) растворенного вещества, то раствор является одно-нормальным (1 н.), если 0,1 грамм-эквивалента, то деци-нормальным (0,1 н.), если 0,01 грамм-эквивалента, то сантинормальным (0,01 н.) и т. д.
Для расчета нормальной концентрации растворов также необходимо знать формулу вещества.